La validación de un sistema informático (o CSV, por sus siglas en inglés) nos permite demostrar que el sistema se comporta acorde a lo esperado, y que cumple la normativa vigente. Tal y como sabemos, esta validación no involucra únicamente las fases iniciales en las que se realiza un diseño del proyecto o la cualificación inicial, sino que acompaña durante todo el ciclo de vida del sistema, incluyendo el periodo operativo y la retirada del sistema.
Una vez finaliza la validación inicial del sistema informático, los procesos de validación relacionados con el sistema no finalizan. La normativa vigente no solo exige la validación de los procesos de fabricación en la industria farmacéutica, sino que una vez validados, deben ser objeto de un seguimiento continuo para demostrar que se mantienen bajo control y dan lugar a un producto de calidad. Este seguimiento debe mantenerse durante todo el ciclo de vida del producto para garantizar la calidad prevista en el diseño.
Debe quedar claro que la validación de un sistema informático (o CSV, por sus siglas en inglés) no finaliza nunca. Una vez finaliza la validación inicial del sistema, la cual permite su implementación en un entorno operativo, será necesario seguir realizando una verificación continuada durante su ciclo de vida.
Si ya has validado ya tu sistema informático, entonces las revisiones periódicas de CSV son el siguiente paso importante.
En este post explicaremos:
- qué es una revisión periódica CSV,
- cuál es su propósito,
- y con qué frecuencia debe realizarse.
También hablaremos del proceso a seguir y la documentación mínima necesaria para realizar una revisión periódica basada en el riesgo de sus sistemas validados.
¿Qué es una «revisión periódica» en CSV?
Una Revisión Periódica es una evaluación de diversos elementos de un sistema para determinar su estado de validación y qué acciones necesarias se deben realizar para mantener el estado validado, mediante la cual demostraremos y garantizaremos que sigue siendo apto para el uso previsto.
Por tanto, a diferencia de una validación inicial o un ciclo de validación asociado a un cambio durante el ciclo de vida del producto (ambos casos ejemplificados en la imagen 1), la revisión periódica no busca implementar un sistema o modificarlo acorde a los requerimientos existentes, sino garantizar y documentar que:
- El sistema y sus funcionalidades se ajustan a los requerimientos definidos al inicio del proyecto.
- Se cumplen las políticas internas de la compañía para su mantenimiento y control.
- Se mantiene el estado de validación durante todo el ciclo de vida del sistema.
¿Qué entendemos por «mantenimiento del estado validado»?
Para mantener el estado validado de un sistema, la compañía debe tomar todas las medidas necesarias para documentar y analizar los cambios, desviaciones o fallos en su funcionamiento, a fin de determinar si sigue siendo adecuado para el propósito y el proceso al que sirve.
«Mantener el estado validado» incluye la demostración continua de que el proceso de fabricación permanece bajo control y da como resultado un producto que garantiza la calidad y la seguridad del paciente. Esto se consigue mediante la revisión de los datos del proceso, controles de cambios, desviaciones, acciones correctivas y preventivas, y otras actividades relacionadas.
¿Cuál es el objetivo de las revisiones periódicas del CSV?
El objetivo de una revisión periódica es confirmar y documentar que los sistemas se mantienen en un estado validado y cumplen todas las normas, procedimientos y políticas de la compañía aplicables a lo largo del ciclo de vida operativo.
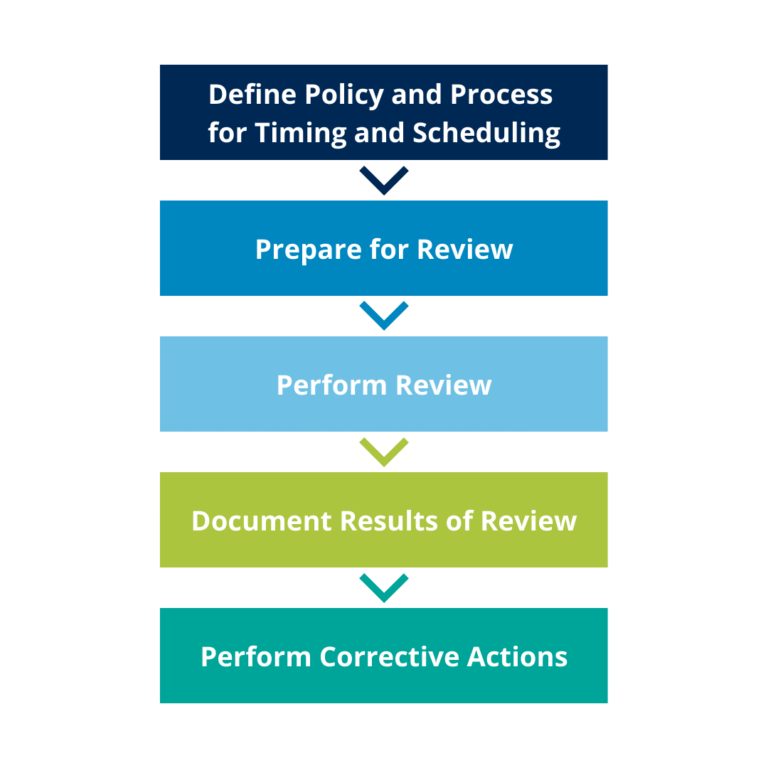
Proceso de revisión periódica del CSV
Por lo general, el proceso que elija para realizar las Revisiones Periódicas del CSV debe estar descrito en un procedimiento normalizado de trabajo (PNT) con las plantillas necesarias para realizar la evaluación.
En caso de disponer de varios sistemas informatizados que requieran realizar una revisión periódica, es aconsejable tener un procedimiento global independiente, el cual se referencie en el procedimiento de validación de cada uno de los sistemas. Si, en caso contrario, existen en su compañía un número muy limitado de sistemas a revisar periódicamente, es aceptable describir este proceso en el propio protocolo de validación del sistema. Hay que tener en cuenta que esta última opción presenta el riesgo añadido de tener potencialmente diferentes sistemas con diferentes criterios para realizar la revisión periódica, por tanto, en caso de escoger esta alternativa se debe prestar especial atención a que los criterios descritos en cada protocolo sean consistentes.
Este PNT debe describir claramente los aspectos que se deben evaluar durante la revisión periódica del sistema. Estos deben ser generales y aplicables a todos los sistemas de una compañía. Estas evaluaciones contienen, como mínimo, los siguientes elementos:
- Auditorias/Revisiones periódicas previas: En caso de que no sea la primera revisión periódica ejecutada, debería verificarse la existencia de documentación para la última revisión periódica. Esta documentación debería evidenciar que todas aquellas acciones correctoras identificadas durante la realización de dicha revisión periódica se han implementado adecuadamente.
- Elementos de la infraestructura del sistema: Todos los elementos se encuentran correctamente actualizados y su diseño y configuración se ajusta a lo descrito en las especificaciones.
- Documentación: Toda la documentación del sistema (instrucciones de uso y otros manuales, protocolos, especificaciones, y otros documentos de validación aplicables) está completa, actualizada y disponible.
- Usuarios/Formación: Se debe garantizar que todos los usuarios tienen acceso al sistema con los permisos que corresponden a su rol, y que estos se encuentran adecuadamente formados para la función que ejercen dentro del sistema. Este material de formación, tal y como se ha verificado en el apartado anterior, debe de ser completo, actual y disponible a aquellos usuarios que lo necesitan.
- Seguridad y control de acceso: Durante la validación inicial del sistema, se configuraron unas medidas de seguridad físicas lógicas, las cuales incluyen el acceso al sistema mediante una combinación única de usuario y contraseña. Se debe verificar que todas esas medidas de seguridad siguen activas y existen protocolos actualizados frente a incidentes o desastres inesperados que puedan afectar al sistema.
- Copias de seguridad: Se debe confirmar que el sistema genera copias de seguridad de los datos acorde a lo establecido en los protocolos aplicables (tanto por contenido como por periodicidad), y que son adecuadas para asegurar que se puede restaurar el sistema en caso de ser necesario.
- Incidentes/Cambios: Durante el ciclo de vida de un sistema es bastante probable que se detecten incidencias o se tengan que realizar modificaciones sobre lo que se haya diseñado inicialmente. La revisión periódica debe asegurar que todos estos incidentes y cambios han sido registrados y gestionados adecuadamente acorde a los protocolos existentes y que el estado actual de estos cambios es el correcto.
Adicionalmente al protocolo, al tratarse de revisiones muy estandarizadas para los diferentes sistemas que puedan existir, es recomendable realizar plantillas tanto para la ejecución de las pruebas como para creación de los informes que documenten los resultados obtenidos. Estas plantillas no se deben considerar como una versión definitiva, sino actualizables y revisables de forma continua para ajustarse de forma más precisa a las necesidades de la compañía. El objetivo de estas es no solo asegurar un contenido y calidad adecuada en las actividades a realizar minimizando el riesgo a sufrir desviaciones documentales durante el proceso, sino también simplificar y agilizar la resolución de las actividades necesarias.
Por último, es posible que durante el proceso se identifiquen desviaciones y aspectos que requieran de una mejora. Estas han de gestionarse adecuadamente, en función de los protocolos existentes y a las políticas de empresa, y hemos de asegurarnos que los responsables para gestionarlos estén adecuadamente informados de su existencia.
Frecuencia de las revisiones periódicas del CSV
La frecuencia de las revisiones periódicas se debe determinar dependiendo del impacto GxP del sistema. Una vez se libera el sistema o equipo para su uso productivo, se recomienda realizar las revisiones periódicas como mínimo con una frecuencia anual. Esta frecuencia, junto con los criterios que la justifiquen, debe quedar claramente indicada en los procedimientos correspondientes.
Los elementos más comunes a considerar durante una revisión periódica del CSV
Los elementos más comunes a tener en cuenta durante una revisión periódica son:
- El anterior informe de revisión periódica, así como las acciones y recomendaciones realizadas.
- Historial de cambios del sistema
- Registros de mantenimiento, registros de calibración y registros de uso del sistema
- Documentación, que incluye procedimientos, registros de formación de usuarios actuales, documentos de validación y documentos del ciclo de vida del sistema
- Matriz de usuarios del sistema actualizada, junto con la matriz de formación de usuarios
- Registros de calidad, como desviaciones, CAPAS, auditorías, registros de cambios, etc.
- Registro de auditoría del sistema
- Rendimiento del sistema
Consideraciones
Antes de finalizar, es importante tener en cuenta estas últimas consideraciones en relación con las revisiones periódicas en CSV:
- El proceso de revisión periódica debe ser general y aplicable a todos los sistemas. Debe aplicarse en los entornos operativos y no en los de desarrollo o de prueba. La profundidad y el rigor de la revisión deben basarse en el impacto, la complejidad y la novedad del sistema, o en la naturaleza de un incidente o suceso que desencadene una revisión.
- Cuando proceda, la Revisión Periódica del sistema informático podrá realizarse como parte de una actividad más amplia, como puede ser la Revisión Periódica de un proceso de producción.
- Las revisiones periódicas deben tener en cuenta y referenciar otras revisiones según corresponda, como la revisión de los registros de seguridad o revisiones de integridad de datos, para evitar duplicar actividades.
- Puede ser útil elaborar listas de verificaciones (checklists) para las revisiones periódicas que sean específicas de sistemas concretos.
- Debe establecerse un proceso para programar las revisiones basado en el impacto, complejidad y novedad del sistema.
- Sea cual sea el método elegido, el proceso debe estar documentado y aprobado por la dirección de la compañía, dejando claramente definida la responsabilidad y los criterios de decisión. También debe definirse con claridad la responsabilidad de la gestión del proceso de planificación y programación y de la asignación de recursos para las revisiones.
¿Necesitas ayuda?
En QbD Group tenemos una amplia experiencia realizando validaciones de sistemas informáticos. ¿Necesitas ayuda con la preparación de tus PNT y plantillas para la Revisión Periódica de tus sistemas? ¿O prefieres que un experto te apoye en el proceso completo de revisiones periódicas de todos tus sistemas GxP? Nuestro equipo estará encantado de ayudarle. No dudes en ponerte en contacto con nosotros.
Guía completa para la validación de sistemas informáticos
Esta guía de más de 100 páginas pretende contextualizar y definir las estrategias necesarias y adecuadas para la validación de sistemas informatizados para Industrias Farmacéuticas, Biológicas, Biotecnológicas, Hemoderivados, Medicamentos y Productos Sanitarios, utilizados en actividades relacionadas con el cumplimiento de las Buenas Prácticas (GxP). Descárguelo ahora gratuitamente: