Introducción
¿Sabías que la precisión de los métodos analíticos influye directamente en la seguridad y eficacia de los productos farmacéuticos? Conocer las guías más recientes sobre validación de métodos no es sólo un requisito reglamentario; es la clave de la garantía de calidad.
En una era en la que la precisión y la fiabilidad en la fabricación de medicamentos son más críticas que nunca, la guía ICH Q2(R2) emerge como un modelo de normalización y excelencia. No sólo refleja los últimos avances científicos en procedimientos analíticos, sino que también se ajusta perfectamente a las directrices ICH Q14 sobre desarrollo de procedimientos analíticos.
Esta revisión exhaustiva introduce un enfoque innovador de la validación de métodos analíticos, que abarca tanto las técnicas tradicionales como las modernas. Desde el análisis espectral hasta los métodos estadísticos multivariantes, la nueva directriz encierra una perspectiva de futuro sobre los procesos de validación de medicamentos.
En este artículo, te desciframos las complejidades de la norma ICH Q2(R2), y te descubrimos ideas prácticas sobre cómo aplicar estas directrices para mejorar tus procesos de validación analítica. Tanto si trabajas en control de calidad, I+D o asuntos regulatorios, esta guía te proporcionará los conocimientos necesarios para desenvolverte con eficacia a través de las nuevas normas.
Entendemos todos los retos a los que te enfrentas para mantenerte al día de los cambios normativos y garantizar que tus métodos analíticos cumplen las normas más estrictas. Por eso hemos comprimido la esencia de las guías ICH Q2(R2) en un formato exhaustivo pero claro, que te permitirá dirigir tus proyectos con confianza y cumplimiento.
El texto final de ICH Q2(R2) sobre «Validación de Procedimientos Analíticos»ha sido adoptado por la Asamblea de Miembros Reguladores de ICH y entrará en vigor el 14 de junio.
Puedes leer la guía revisada completa aquí: ICH Q2(R2)
El nuevo ICH Q2(R2) es una revisión completa de la guía para incluir una aplicación más reciente de los procedimientos analíticos y para alinear los contenidos con ICH Q14 «Desarrollo de procedimientos analíticos».
Antecedentes de ICH Q2
¿Que representant las guías «Q’s» de Calidad«?
Los logros de la armonización en el área de Calidad incluyen hitos fundamentales como la realización de estudios de estabilidad, la definición de los límites correspondientes para el ensayo de impurezas y un enfoque más flexible de la calidad farmacéutica basado en la gestión de riesgos de las Buenas Prácticas de Fabricación (GMP).
Este complejo trabajo a través de la temática de la Calidad dirige a las 14 guías Q de Calidad , que se enumeran a continuación:
Referencia de la guía ICH | Tema y título de la serie | Título del subtema o descripción del tema | Q1 | Estabilidad | A. Pruebas de estabilidad de nuevas sustancias y productos farmacéuticos
B. Pruebas de estabilidad: Pruebas de fotoestabilidad de nuevas sustancias y productos farmacéuticos
C. Pruebas de estabilidad para nuevas formas farmacéuticas
D. Diseños de bracketing y matricialización para pruebas de estabilidad de nuevas sustancias y productos farmacéuticos
E. Evaluación de los datos de estabilidad
F. Paquete de datos de estabilidad para solicitudes de registro en las zonas climáticas III y IV |
|---|---|---|
Q2
Q2(R2)/Q14 | Validación analítica | Validación de Procedimientos Analíticos: Texto y metodología |
Q3 | Impurezas | A. Impurezas en las nuevas sustancias farmacológicas
B. Impurezas en los nuevos medicamentos
C. Mantenimiento de la directriz sobre disolventes residuales
D. Directriz para las impurezas elementales
E. Impurezas: Evaluación y control de extraíbles y lixiviables para productos farmacéuticos y biológicos |
Q4 | Farmacopeas | A. Armonización farmacopeica
B. Evaluación y recomendación de textos de farmacopea para su uso en las regiones ICH |
Q5 | Calidad de la biotecnología
Productos | A. Evaluación de la seguridad vírica de los productos biotecnológicos derivados de líneas celulares de origen humano o animal
B. Análisis del constructo de expresión en células utilizadas para la producción de productos proteicos derivados del ADNr
C. Calidad de los productos biotecnológicos: Pruebas de estabilidad de productos biotecnológicos/biológicos
D. Derivación y caracterización de sustratos celulares utilizados para la producción de productos biotecnológicos/biológicos
E. Comparabilidad de los productos biotecnológicos/biológicos sujetos a cambios en su proceso de fabricación |
Q6 | Especificaciones | A. Especificaciones: Procedimientos de prueba y criterios de aceptación de nuevas sustancias y nuevos productos farmacéuticos: Sustancias químicas
B. Especificaciones: Procedimientos de ensayo y criterios de aceptación para productos biotecnológicos/biológicos |
Q7
Q7 Preguntas y respuestas | Buenas prácticas de fabricación
Guía del farmacéutico activo
Ingredientes | Este documento tiene por objeto proporcionar orientaciones relativas a las Buenas Prácticas de Fabricación (GMP) para la fabricación de Ingredientes Farmacéuticos Activos (APIs) en el marco de un sistema adecuado de gestión de la calidad. |
Q8
Preguntas y respuestas Q8/9/10
Q8/9/10
Aplicación | Desarrollo farmacéutico | Describir los contenidos sugeridos para la sección 3.2.P.2 (Desarrollo farmacéutico) de una presentación reglamentaria. La sección de Desarrollo Farmacéutico debe describir los conocimientos que establecen que el tipo de forma farmacéutica seleccionada y la formulación propuesta son adecuados para el uso previsto. |
Q9 | Gestión de riesgos de calidad | Proporcionar principios y ejemplos de herramientas para la gestión del riesgo de calidad que puedan aplicarse a distintos aspectos de la calidad farmacéutica. |
Q10 | Sistema de calidad farmacéutica | Describir un modelo integral para un sistema de calidad farmacéutica eficaz que se base en los conceptos de calidad de la Organización Internacional de Normalización (ISO), incluya la normativa aplicable sobre Buenas Prácticas de Fabricación (GMP) y complemente las normas ICH Q8 e ICH Q9. |
Q11
Q11 Preguntas y respuestas | Desarrollo y fabricación de medicamentos | Entidades químicas y entidades biotecnológicas/biológicas
Describir enfoques para desarrollar y comprender el proceso de fabricación de la sustancia farmacológica, y también proporcionar orientación sobre qué información debe facilitarse en el expediente. |
Q12 | Técnica y reglamentación
Consideraciones para
Producto farmacéutico
Gestión del ciclo de vida | Proporcionar un marco que facilite la gestión de los cambios químicos, de fabricación y de control (CMC) posteriores a la aprobación de una manera más predecible y eficiente. |
Q13 | Fabricación continua de sustancias y productos farmacéuticos | Se basa en las actuales directrices de calidad de la ICH, aclara los conceptos de fabricación continua (FC), describe enfoques científicos y presenta consideraciones normativas específicas de la FC de sustancias y productos farmacéuticos;
Se centra en los aspectos integrados de un sistema de fabricación contínua en el que dos o más operaciones unitarias están directamente conectadas;
Describe las consideraciones científicas y regulatorias para el desarrollo, la aplicación, el funcionamiento y la gestión del ciclo de vida de la FC. |
Q14
Q2(R2)/Q14 | Desarrollo de procedimientos analíticos | El EWG Q2(R2)/Q14 elaboró una nueva guideline de calidad de la ICH, ICH Q14, sobre el desarrollo de procedimientos analíticos, y revisó la guideline ICH Q2(R1) sobre la validación de procedimientos analíticos. |
- Los 30 años de Historia de la Q2:
Código | Historia | Fecha | Q2 | Aprobación por el Comité Director en la etapa 2 y publicación para su consulta pública | 26 de octubre de 1993 |
|---|---|---|
Q2A | Aprobación por el Comité Directivo en el Paso 4 y recomendación de adopción a los tres organismos reguladores de la ICH. | 27 de octubre de 1994 |
Q2B | Aprobación por el Comité Director en la etapa 2 y publicación para consulta pública | 29 de noviembre de 1995 |
Q2B | Aprobación por el Comité Directivo en el Paso 4 y recomendación de adopción a los tres organismos reguladores de la ICH. | 6 de noviembre de 1996 |
Q2(R1) | La guideline principal pasa a llamarse Q2(R1), ya que la guideline Q2B sobre metodología se ha incorporado a la guideline principal. El nuevo título es «Validación de procedimientos analíticos: Texto y Metodología». | Noviembre de 2005 |
Q2(R2) | Revisión completa de la guideline para incluir la aplicación más reciente de procedimientos analíticos y alinear el contenido con la Q14. Aprobación por los miembros de la Asamblea de la ICH en la etapa 2 y publicación para consulta pública. | 24 de marzo de 2022 |
Q2(R2) | Adopción de parte de los Miembros Reguladores de la Asamblea de la ICH en el Paso 4. | 1 de noviembre de 2023 |
Q2(R2) | Corrección de errores de la Tabla 5: Disolución con HPLC como prueba de rendimiento del producto para una forma farmacéutica de liberación inmediata Rango Reportable Fórmulas de linealidad en la página 25; Corrección de las Tablas 6-11 en las páginas 26-32 | 30 de noviembre de 2023 |
- 2024: la mezcla esencial de Q2(R2)/Q14
- ICH Q2(R2) proporciona directrices para demostrar que un procedimiento analítico es adecuado para su finalidad.
- LA NORMA ICH Q14 describe principios científicos y un enfoque basado en el riesgo para el desarrollo de procedimientos analíticos adecuados.
¿POR QUÉ?
Juntas, las normas ICH Q2(R2) e ICH Q14 cubren el desarrollo y las actividades de validación utilizadas para evaluar la calidad del producto durante el ciclo de vida de un procedimiento analítico.
Las nuevas ICH Q2(R2) y Q14 se desarrollaron en paralelo y pretenden complementar las Q8 a Q12, así como la Q13.
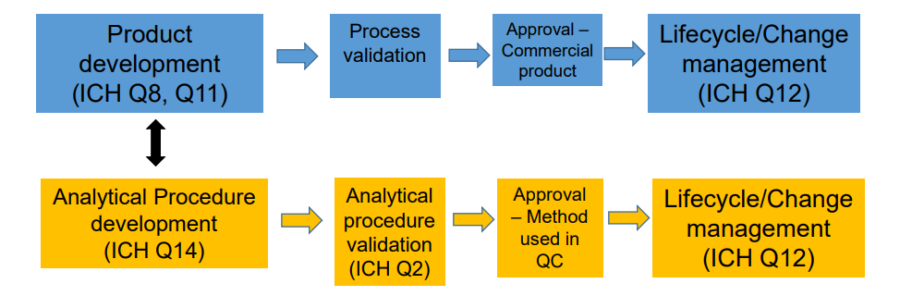
Las nuevas ICH Q2(R2) y Q14 se desarrollaron en paralelo y pretenden complementar las Q8 a Q12, así como la Q13.
Objetivo de la validación del procedimiento analítico
El sitio ICH Q2(R2) presenta elementos a tener en cuenta durante la validación de los procedimientos analíticos incluidos como parte de las solicitudes de registro. Orienta sobre la selección y evaluación de las distintas pruebas de validación de los procedimientos analíticos.
Esta directriz incluye una colección de términos y sus definicionesque pretenden salvar las diferencias que a menudo existen entre los diversos compendios y documentos de las autoridades reguladoras miembros de la ICH.
Ámbito de aplicación de ICH Q2(R2)
El ámbito de aplicación de la revisión de ICH Q2(R1) incluye principios de validación que abarcan el uso analítico de datos espectroscópicos o espectrométricos (por ejemplo, NIR, Raman, RMN o MS), algunos de los cuales a menudo requieren análisis estadísticos multivariantes.
Esta guideline se aplica a los procedimientos analíticos nuevos o revisados utilizados para las pruebas de liberación y estabilidad de sustancias y productos farmacéuticos comerciales (químicos y biológicos/biotecnológicos). La guideline también puede aplicarse a otros procedimientos analíticos utilizados como parte de la estrategia de control siguiendo un enfoque basado en el riesgo.
Esta nueva guideline pretende mejorar la comunicación regulatoriaentre la industria y los organismos reguladores y facilitar una aprobación científica y basada en el riesgo más eficiente y sólida así como la gestión de los cambios en los procedimientos analíticos tras su aprobación.
Principales cambios en la ICH Q2
Aquí encontrarás en qué consisten los principales cambios de la nueva ICH Q2(R2), así como la nueva filosofía y mentalidad en torno a las actividades de validación:
- Los datos adecuados derivados de estudios de desarrollo (véase ICH Q14) pueden utilizarse como parte de los datos de validación.
- Cuando un procedimiento analítico de plataforma se utiliza para un nuevo fin es posible reducir las pruebas de validación, cuando esté científicamente justificado.
- Algunos definiciones se han modificado ser más alineados con procedimientos analíticos biológicos y no lineales en cuanto a linealidad → Intervalo notificable.
- Se ha actualizado la tabla de características de rendimiento frente a las pruebas de validación:
La linealidad se ha sustituido por «Rango de trabajo» y consta de «Idoneidad del modelo de calibración» y «Verificación del límite inferior del rango» (QL/DL).
En función de la preparación de la muestra y del procedimiento analítico seleccionado, el intervalo notificable dará lugar a un intervalo de trabajo específico.
Aquí encontrarás en qué consisten los principales cambios de la nueva ICH Q2(R2), así como la nueva filosofía y mentalidad en torno a las actividades de validación:
- Los datos adecuados derivados de estudios de desarrollo (véase ICH Q14) pueden utilizarse como parte de los datos de validación.
- Cuando un procedimiento analítico de plataforma se utiliza para un nuevo fin es posible reducir las pruebas de validación, cuando esté científicamente justificado.
- Algunos definiciones se han modificado para estar más alineados con procedimientos analíticos biológicos y no lineales en cuanto a linealidad → Intervalo notificable.
- Se ha actualizado la tabla de características de rendimiento frente a las pruebas de validación: La linealidad se ha sustituido por «Rango de trabajo» y consta de «Idoneidad del modelo de calibración» y «Verificación del límite inferior del rango» (QL/DL).En función de la preparación de la muestra y del procedimiento analítico seleccionado, el intervalo notificable dará lugar a un intervalo de trabajo específico.
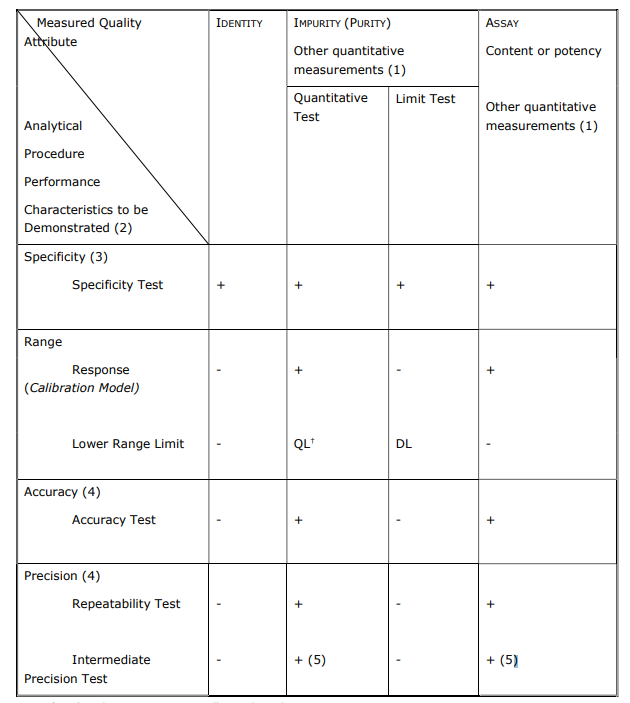
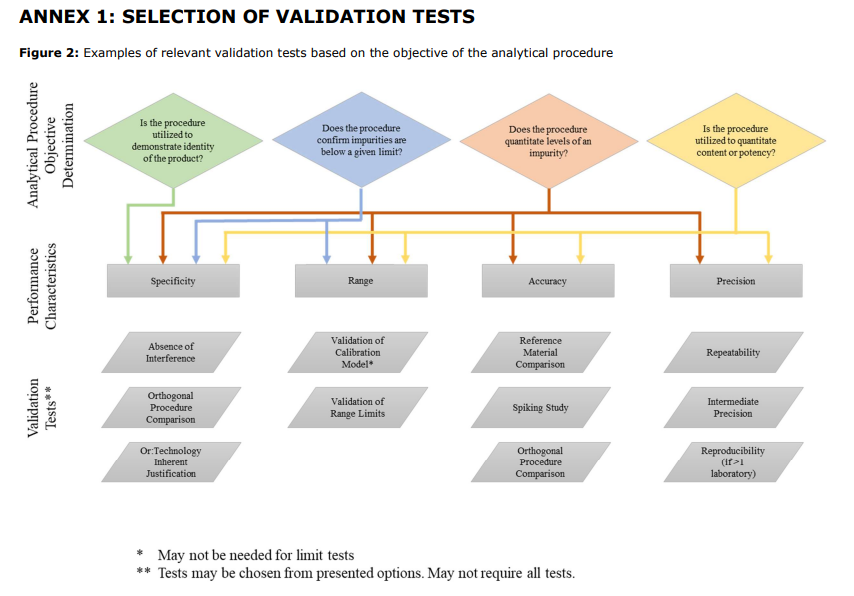
- Nuevo Anexo 1
- El concepto de calibración multivariante se ha añadido. Los algoritmos de calibración multivariante pueden ser lineales o no lineales, siempre que el modelo sea adecuado para establecer la relación entre la señal y el atributo de calidad de interés. La evaluación de la linealidad, aparte de la comparación de los resultados de referencia y previstos, debe incluir información sobre cómo cambia el error del procedimiento analítico (residuos) a lo largo del intervalo de calibración.
- Validación durante el ciclo de vidaSe han añadido los conceptos de «Co-validación» y «Validación cruzada» y están en consonancia con el objetivo de ICH-Q14:
- armonizar los enfoques científicos para desarrollar y validarlos procedimientos analíticos.
- combinar el enfoque de la Q14 teniendo en cuenta el Perfil Analítico Objetivo (ATP) para definir los atributos calidad y los criterios de rendimiento del procedimiento analítico.
- para proporcionarorientación sobre cómo gestionar los cambios en los procedimientos analíticos
- Para complementar la ICH Q2(R2)
Beneficios esperados de ICH Q2(R2)
El objetivo del desarrollo y la validación es obtener un procedimiento analítico adecuado para el fin previsto: medir un atributo o atributos del material con la especificidad/selectividad, exactitud y precisión necesarias en el intervalo notificable.
Si bien el enfoque mínimo de la norma ICH Q2(R2) sigue siendo un enfoque aceptable para el desarrollo de un procedimiento analítico sólido que sea adecuado para el fin previsto, algunos o todos los elementos del enfoque mejorado de la norma ICH Q2(R2) podrían utilizarse para apoyar el desarrollo, la validación y la gestión del ciclo de vida de los procedimientos analíticos.
Estos conceptos aumentan las ventajas de la nueva ICH Q2(R2)/Q14:
- Ampliación del ámbito de aplicación a todos los métodos no lineales, biológicos y multivariantes.
- Posibilidad de utilizar datos de desarrollo y conocimientos previos para complementar la validación.
- Metodología general revisada para incluir productos biotecnológicos y evaluaciones de datos estadísticos.
- Aclaración de la terminología para salvar las diferencias que a menudo existen entre los distintos documentos de los compendios.
- El anexo 2 es coherente: Ejemplos ilustrativos de técnicas analíticas.
Conclusión
Lanueva versión de ICH Q2(R2) es una guideline completamente revisada, modernizada para incluir requisitos de los productosbiotecnológicos y fomentar el uso de procedimientos analíticos más avanzados que conducen a datos más sólidos de validación y evaluar la calidad de los productos en línea con ICH-Q14.
¿Necesitas ayuda para validar tus procedimientos analíticos?
Nuestros expertos estarán encantados de ayudarte con el el mejor programa de validación de acuerdo a tus recursos disponibles.No dudes en ponerte en contacto con nosotros si tienes alguna pregunta.
