¿Qué es la validación de métodos analíticos?
La validación de métodos analíticos es un proceso crítico en las industrias farmacéutica, biotecnológica y alimentaria para garantizar la calidad y seguridad de los productos.
El objetivo de la validación de un método analítico es demostrar que es adecuado para el fin previsto. Tanto el método como su uso previsto deben estar claramente definidos. Esto significa que el método debe estar completamente desarrollado y optimizado antes de iniciar la validación del método.
Deben conocerse los siguientes parámetros:
- ¿Qué analitos se van a analizar?
- ¿Cuáles son sus niveles de concentración previstos?
- ¿Cuál es la matriz de la muestra y se espera alguna interferencia?
- ¿El método debe arrojar un resultado cuantitativo o cualitativo?
En este blog, exploraremos los criterios que hay que tener en cuenta a la hora de validar un método analítico.
ARTÍCULO DE EXPERTO GRATUITO
Validación de métodos analíticos
En esta publicación, daremos una visión general de los criterios a tener en cuenta a la hora de validar tu método analítico.
¿Qué hace que un método analítico sea «adecuado» para el uso previsto?
Ahora bien, ¿qué hace que un método analítico sea «adecuado«? Un método analítico se considera adecuado cuando se ha establecido que los resultados generados por el método son coherentes, reproducibles y fiables.
Los parámetros necesarios (como mínimo) para establecer la idoneidad se describen en la directriz ICH Q2a: Validación de Procedimientos Analíticos: Texto y metodología (véase el cuadro 1).
Nota: no es obligatorio que estas pruebas se realicen por separado, por lo que está permitido crear un conjunto de datos mayor para poder determinar varios parámetros en una sola ejecución.
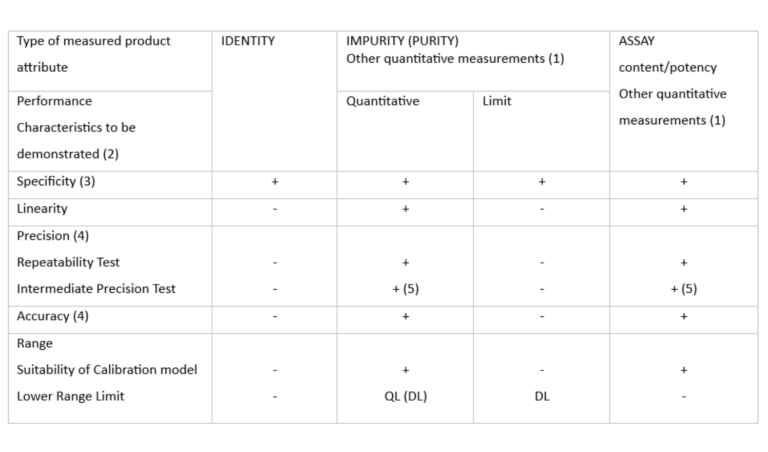
Cuadro 1: Características de funcionamiento típicas y pruebas de validación relacionadas para los atributos medidos del producto (ICH Q2)
- «-» significa que esta prueba no se realiza habitualmente
- «+» significa que esta prueba se realiza normalmente
- ( ) significa que esta prueba no suele realizarse, pero en algunos casos complejos se recomienda
- QL, DL: Límite de cuantificación, Límite de detección
- (1) Otras mediciones cuantitativas pueden seguir el esquema de ensayo de impurezas, si el intervalo de trabajo está próximo a los límites de detección o cuantificación de la tecnología; en caso contrario, se recomienda seguir el esquema de ensayo.
- (2) algunas características de rendimiento pueden sustituirse por una justificación o cualificación inherente a la tecnología en el caso de determinados procedimientos analíticos para propiedades fisicoquímicas.
- (3) puede utilizarse un enfoque combinado como alternativa para evaluar la exactitud y la precisión por separado
- (4) la falta de especificidad de un procedimiento analítico podría compensarse con otro u otros procedimientos analíticos de apoyo
- (5) La reproducibilidad y la precisión intermedia pueden realizarse como un único conjunto de experimentos.
Características típicas de la validación de métodos analíticos
Especificidad
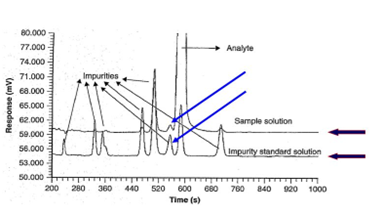
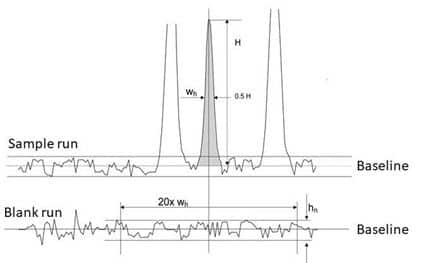
La especificidad es la capacidad del método para medir únicamente el analito de interés sin interferencia de otros componentes de la muestra que puedan estar presentes, como impurezas, degradantes, componentes de la matriz, etc. Puede evaluarse analizando muestras que contengan el analito de interés y posibles sustancias interferentes.
Las pruebas utilizadas para demostrar la especificidad dependerán del uso previsto del procedimiento analítico; las pruebas de identificación adecuadas deben poder discriminar entre compuestos de estructuras estrechamente relacionadas, mientras que las pruebas de ensayo o pureza adecuadas deben poder discriminar entre el analito, las impurezas, los productos de degradación y/o los componentes de la matriz.
Figura 1: Ejemplo de especificidad de un método (ref3)
Linealidad
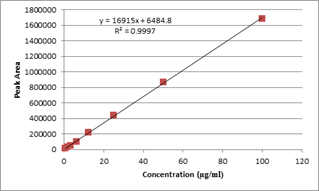
El método analítico debe ser lineal, es decir, debe existir una relación directa entre la concentración del analito o analitos y la señal producida.
La linealidad suele evaluarse analizando por triplicado muestras que contienen el analito a 5 niveles de concentración diferentes. A continuación, se crea un gráfico de las señales en función de la concentración o el contenido del analito, normalmente mediante una línea de regresión. Debe calcularse el coeficiente de correlación, la intersección y, la pendiente de la línea de regresión y la suma de cuadrados residuales.
En caso de que un método analítico no demuestre linealidad, incluso después de cualquier transformación, la respuesta analítica debe describirse mediante una función apropiada de la concentración (cantidad) de un analito en una muestra.
Precisión
La precisión es el grado de concordancia (grado de dispersión) entre mediciones repetidas de la misma muestra en las mismas condiciones.
Se mide calculando la desviación típica (relativa) y el intervalo de confianza de las mediciones repetidas de múltiples muestreos de la misma muestra homogénea. Se definen tres niveles de precisión: repetibilidad, precisión intermedia y reproducibilidad.
- Repetibilidad: precisión establecida en las mismas condiciones de funcionamiento durante un corto espacio de tiempo utilizando un mínimo de 6 determinaciones al 100% de la concentración de ensayo o 3 réplicas de 3 concentraciones.
- Precisión intermedia: debe establecer los efectos de los sucesos aleatorios en la precisión del procedimiento analítico calculado utilizando un mínimo de 6 determinaciones al 100% de la concentración de ensayo. Variaciones típicas dentro del laboratorio, como días, analistas, equipos, etc.
- Reproducibilidad: distintos analistas de distintos laboratorios deben poder obtener resultados similares. Suele probarse en caso de transferencia de métodos
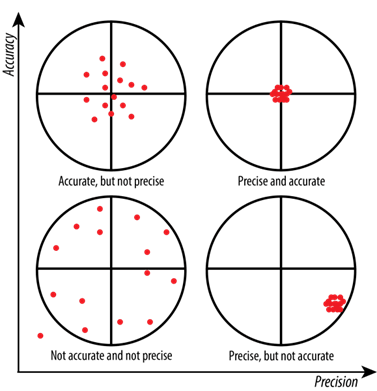
Figura 4: Precisión frente a exactitud (ref6)
Precisión
La precisión es la proximidad de los resultados de la prueba al valor real o teórico. La precisión se evalúa utilizando un mínimo de 9 determinaciones en un mínimo de 3 niveles de concentración que cubran el intervalo especificado (por ejemplo, 3 réplicas de cada una de las 3 concentraciones del intervalo). La exactitud se expresa entonces como porcentaje de recuperación de la cantidad teórica de analito en la muestra, junto con los intervalos de confianza.
Gama
El intervalo especificado se deriva normalmente de estudios de linealidad y depende de la aplicación prevista del procedimiento.
Se establece confirmando que el procedimiento analítico proporciona un grado aceptable de linealidad, exactitud y precisión cuando se aplica a muestras que contienen cantidades de analito dentro o en los extremos del intervalo especificado del procedimiento analítico.
Figura 5: Alcance (ref7)
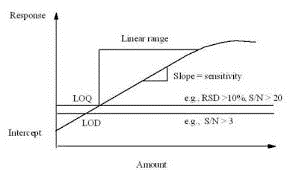
El método analítico debe ser capaz de detectar y cuantificar con precisión niveles bajos de analitos:
- El límite de cuantificación (LOQ ) es la cantidad más baja de un analito que puede cuantificarse con la exactitud y precisión adecuadas.
- El límite de detección (LOD) es la cantidad más baja de un analito que puede detectarse, pero no necesariamente cuantificarse.
Figura 6: LOQ frente a LOD (ref 8)
El LOQ y el LOD pueden calcularse utilizando diferentes métodos:
- basada en la evaluación visual,
- en función de la relación señal/ruido,
- o en función de la desviación típica de la respuesta y de la pendiente.
El LOQ debe validarse mediante el análisis de un número adecuado de muestras con concentraciones conocidas iguales o próximas al límite de cuantificación.
Robustez
La evaluación de la robustez debe considerarse durante la fase de desarrollo. Debe mostrar la fiabilidad de un análisis con respecto a las variaciones deliberadas de los parámetros del método.
Un parámetro importante es la estabilidad de la solución de la muestra.
Pruebas de idoneidad del sistema
Las pruebas de idoneidad del sistema forman parte integrante de muchos procedimientos analíticos. Las pruebas se basan en el concepto de que el equipo, la electrónica, las operaciones analíticas y las muestras constituyen un sistema integral que debe evaluarse como tal. Todos los parámetros (calculados) están dentro de los límites aceptables, lo que indica un buen funcionamiento del método y del sistema.
Directrices para la validación de métodos analíticos
La directriz de referencia para la validación de métodos analíticos es la ICH Q2. Las farmacopeas aplicables (USP, EP) describen los requisitos generales relativos al uso de una técnica analítica y también pueden exigir que se incluyan determinados parámetros en las pruebas de idoneidad del sistema. Deben comprobarse antes de cada muestreo, incluidos los de validación del método.
¿Necesitas ayuda para validar tus métodos analíticos?
¿Eres nuevo en la validación de métodos analíticos? ¿O necesitas consejo? Nuestros expertos estarán encantados de ayudarte con el mejor programa de validación de acuerdo con tus recursos disponibles. No dudes en ponerte en contacto con nosotros si tienes alguna pregunta.
Expert knowledge in Qualification & Validation
- ICH Topic Q 2 (R1) Validación de procedimientos analíticos: Texto y Metodología; 1995
- ICH Q2 Validación de métodos analíticos (slideshare.net)
- https://slideplayer.com/slide/6184200/
- https://www.researchgate.net/figure/Calibration-curve-showing-linearity-Validation-protocol-Method-validation-was-executed_fig3_326224323
- https://stats.stackexchange.com/questions/265869/confused-with-residual-sum-of-squares-and-total-sum-of-squares
- Precisión frente a exactitud – Tecnología de la información (stolaf.edu)
- http://pharmaceuticalvalidation.blogspot.com/2010/01/validation-of-analytical-methods-and.html
- Consejos para la resolución de problemas en HPLC: Por qué la relación señal/ruido determina el límite de detección (analyteguru.com)