La EMA define los medicamentos de terapia avanzada como medicamentos de uso humano basados en genes, células o ingeniería de tejidos. Los ATMP son productos innovadores que ofrecen nuevas posibilidades en el tratamiento de diversas enfermedades y lesiones.
Si se observa la figura 1, se puede ver que los ATMP se clasifican a su vez en productos de terapia génica, productos de terapia celular somática y productos de ingeniería tisular. Además de estas tres clasificaciones, existe una cuarta, que combina los ATMP y los productos sanitarios (ATMP combinados).
En este blog, analizaremos con más detalle varias terapias celulares relacionadas con el ATMP que se han descrito como algunos de los avances más prometedores en el tratamiento del cáncer.
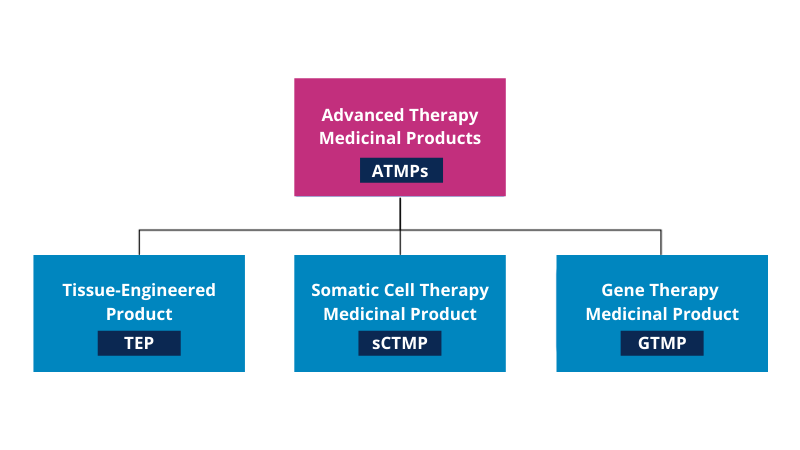
Figura 1 – Resumen esquemático de las ramas de la ATMP
¿Qué es la terapia celular?
La terapia celular incluye todas las formas de tratamiento en las que se utilizan células corporales para curar o apoyar al paciente. Las células se manipulan o editan para cambiar ciertas características biológicas antes de ser transferidas al paciente.
- Cuando estas células proceden de la misma persona (donante = paciente), se habla de terapia celular autóloga.
- En la terapia celular alogénica, se procesan células de otra persona (donante).
- Y, como tercera opción, la terapia celular xenogénica utiliza células animales.
Composición de la sangre – células sanguíneas
La composición de la sangre puede definirse como mitad plasma y mitad células sanguíneas (incluidos los glóbulos rojos, los glóbulos blancos y las plaquetas). Estas células sanguíneas se producen en la médula ósea y se forman a partir de células madre hematopoyéticas (células sanguíneas de primera fase).
- Los glóbulos rojos o eritrocitos son el principal componente de las células sanguíneas y actúan como transportadores de oxígeno desde los pulmones al resto del cuerpo.
- Luego están los glóbulos blancos o leucocitos, que combaten las infecciones y participan en la respuesta inmunitaria.
- Por último, están las plaquetas o trombocitos, que ayudan a la coagulación de la sangre.
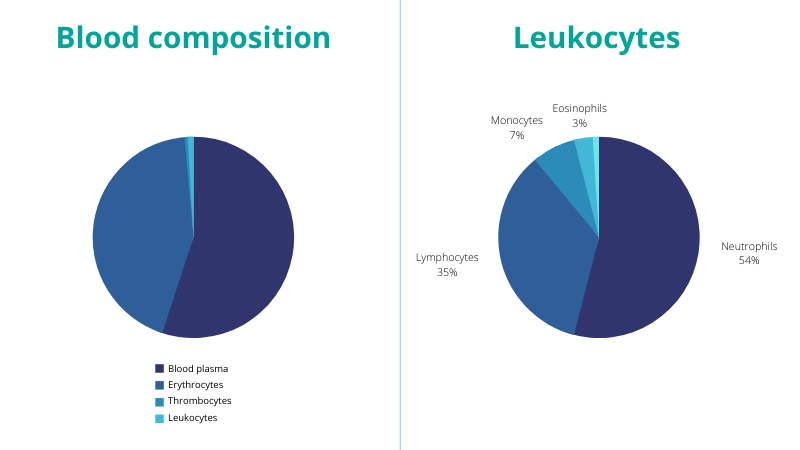
Figura 2 – Composición de la sangre
Los leucocitos pueden distinguirse además en granulocitos y no granulocitos. Se definen 5 subtipos:
- Linfocitos (no granulocitos)
- Monocitos (no granulocitos)
- Eosinófilos (granulocitos)
- Basófilos (granulocitos)
- Neutrófilos (granulocitos)
Los dos tipos principales de linfocitos son los linfocitos T (células T) y los linfocitos B (células B) y un tercer ejemplo de linfocitos son los Células asesinas naturales (NK) . Estos leucocitos son las células que pueden ser objeto de terapia celular porque son activos en la respuesta inmunitaria contra las infecciones. Dentro de los fagocitos mononucleares, son los células dendríticas que son aptos para la terapia celular, mientras que los monocitos y los macrófagos no lo son.
Células utilizadas para el ATMP: terapias celulares actuales relacionadas con el ATMP en el mercado
De las células sanguíneas descritas anteriormente, las células T, las células B, las células DC y las células NK se utilizan en la fabricación de ATMP en el contexto de las terapias celulares, mientras que otras células no sanguíneas se utilizan en el contexto de los productos de ingeniería de tejidos.
Los siguientes apartados ofrecen una visión general de las diferentes terapias celulares utilizadas en la actualidad. Se analizarán las terapias celulares basadas en los linfocitos T, los linfocitos B, las células dendríticas (DC) y las células asesinas naturales (NK), respectivamente. También se ofrecerá una pequeña introducción a los productos actuales de ingeniería de tejidos.
1. Linfocitos T
Los linfocitos T se utilizan en diferentes tipos de inmunoterapias celulares, como la de linfocitos infiltrantes de tumores (TIL), la de células T con receptores de antígenos quiméricos (CAR-T) y la de receptores de células T de ingeniería (TCR).
En la terapia TIL, los linfocitos T se aíslan dentro o cerca de los tumores del paciente. Estos linfocitos T son los que mejor reconocen las células tumorales. Se expanden en el laboratorio y finalmente se reinfunden en el paciente. De este modo, el paciente recibe una gran cantidad de linfocitos T seleccionados que detectan y destruyen activamente los tumores.
La terapia TIL está todavía en fase de ensayo clínico (la fase actual es la fase II) y tiene el mayor énfasis en el tratamiento del melanoma.
CAR-T y terapia TCR ya han sido tratadas en una entrada del blog dedicada y utilizan el mismo principio general: los linfocitos T, extraídos del paciente, son modificados mediante la adición de un gen que codifica para un receptor específico, generando células T CAR y células T TCR respectivamente. Como resultado, estas células poseen la capacidad de detectar y destruir células objetivo malignas.
La diferencia entre ambas técnicas radica en que las células TCR-T sólo pueden dirigirse a las células malignas cuyos antígenos están presentes en la superficie de un complejo mayor de histocompatibilidad o MHC, mientras que las células CAR-T pueden unirse a los antígenos que se presentan en la superficie de las células tumorales.
Esta diferencia es la razón por la que los CAR-T son más eficaces contra los tumores sanguíneos mientras que los TCR-T son más adecuados contra los tumores sólidos.
Múltiples terapias con células T CAR han sido aprobadas por la FDA y la EMA para el tratamiento de múltiples cánceres y pacientes con linfoma o leucemia (Tecartus recibió una licencia condicional de la EMA el 14 de diciembre de 2020); mientras que las TCR-T se encuentran en ensayos clínicos fases I, I/II y II.
2. Linfocitos B
Además de los linfocitos T, los linfocitos B también se utilizan en las inmunoterapias celulares. Mientras que los linfocitos T ayudan a regular la función de otras células inmunitarias y atacan directamente a diversas células infectadas y tumores, los linfocitos B fabrican anticuerpos, que son proteínas que se dirigen específicamente a bacterias, virus y otros materiales extraños.
Además de la producción de anticuerpos, también se están realizando estudios para determinar si los linfocitos B pueden utilizarse en la inmunoterapia del cáncer. Por ejemplo, actualmente se está investigando si las células B activadas por CD40 pueden servir como vacuna celular contra el cáncer. Hasta la fecha, la FDA no ha aprobado ninguna terapia celular basada en linfocitos B.
3. DC (células dendríticas)
Las células dendríticas (DC) se consideran células presentadoras de antígenos (APC ) profesionales que desempeñan un papel crucial en la inmunoterapia tumoral. Reconocen los agentes patógenos y los presentan al sistema inmunitario del paciente.
En la terapia con DC, las células dendríticas se extraen/filtran de la sangre del paciente y durante la maduración se presentan los antígenos del tumor, lo que hace que las DC sean capaces de reconocer las células tumorales en una semana.
A continuación, las DC «entrenadas» se reintroducen en el cuerpo del paciente mediante una inyección o infusión, reforzando el sistema inmunitario del paciente contra el objetivo. Activan las células T citotóxicas del organismo para que se unan a las células cancerosas, provocando su muerte.
Esta terapia con DC es una terapia aprobada que se utilizó por primera vez en los Estados Unidos en 2010 para tratar el cáncer de próstata. No deje de consultar nuestra entrada en el blog sobre las célulasdendríticas y leer más sobre nuestra participación en el proyecto Persomed.
4. Células asesinas naturales (NK)
Las células asesinas naturales (NK) son linfocitos de gran tamaño derivados de células madre hematopoyéticas pluripotentes localizadas en la médula ósea que proporcionan una fuente atractiva y segura de células alogénicas para la inmunoterapia. Son el mecanismo de defensa de primera línea del organismo contra los agentes patógenos (como las células víricas y las cancerosas).
Las células NK son tipos de células efectoras inmunitarias que se defienden contra diversos patógenos (virus como Chlamydia spp., Rickettsia spp., Listeria monocytogenes y protozoos) que causan infecciones directas intracelulares (tanto citoplasmáticas como vesiculares).
Más concretamente, las células NK son activadas por los interferones (proteínas producidas y liberadas en respuesta a la infección) y, con sus receptores activadores e inhibidores invariables, destruyen las células víricas infectadas, algunas células tumorales y otros patógenos intracelulares.
Los receptores de las células NK pueden actuar como activadores o inhibidores cuando se reconoce un ligando celular específico. En el momento del reconocimiento, los receptores de las células NK enviarán una señal positiva o negativa, respectivamente, tras lo cual se puede atacar a las células tumorales.
La respuesta inmunitaria que muestran las células NK es triple: una respuesta inmunitaria citotóxica, una respuesta inmunitaria efectora o una acción inhibidora. En un blog anterior (« Por qué las células NK son un gran avance en los ATMP «).
Para mejorar el reconocimiento y la destrucción de las células tumorales, las células NK son modificados genéticamente para que expresen diferentes tipos de receptores. Un tipo de receptor es el receptor de antígeno quimérico (CAR), que da lugar a Células NK CAR capaces de dirigirse a un tipo muy específico de células/tejidos (tumorales) o de apoyar la función y la supervivencia de las células NK.
Debido a su gran potencial para el tratamiento de las neoplasias hematológicas, así como para el tratamiento de los tumores sólidos, las inmunoterapias basadas en células NK CAR se están investigando actualmente en ensayos clínicos en todo el mundo, pero todavía no se dispone de una inmunoterapia aprobada.
5. Ingeniería de tejidos
La ingeniería de tejidos consiste en combinar células y moléculas biológicamente activas con andamios para formar tejidos funcionales. El andamio actúa como una estructura (hecha de polímeros naturales o sintéticos) que soporta el crecimiento y la diferenciación de las células y da lugar a una estructura similar a un tejido.
El objetivo es generar construcciones funcionales (tejidos funcionales en 3D) que puedan sustituir a los tejidos o puedan utilizarse para mantener o mejorar los tejidos dañados. Actualmente, los ejemplos aprobados conocidos son el cartílago artificial y la piel.
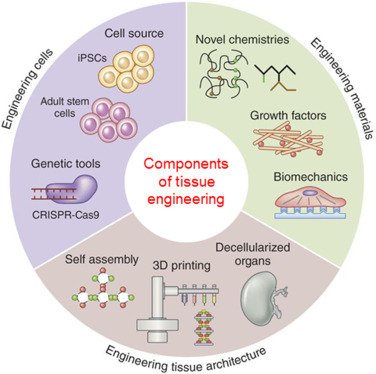
Figura 3 – Componentes de la ingeniería de tejidos
Las células que se utilizan en la ingeniería de tejidos pueden definirse en tres grandes fuentes celulares:
- Células embrionarias (células ES) y células germinales embrionarias equivalentes (células EG)
- Células adultas autólogas o alogénicas
- iPSC (células madre pluripotentes inducidas)
Células madre mesenquimales (MSC)
Las células madre mesenquimales (MSC) son células madre adultas que pueden aislarse principalmente de la médula ósea y el tejido adiposo, pueden proliferar hasta muchas generaciones y poseen la capacidad de diferenciarse en líneas celulares principalmente osteogénicas, condrogénicas y adipogénicas. Pueden utilizarse en el proceso de curación de los defectos de los tejidos.
Condrocitos autólogos
Los condrocitos autólogos pueden combinarse con andamios de cartílago biomiméticos, lo que da lugar a un cartílago de ingeniería tisular in vitro que luego puede trasplantarse a los pacientes para reparar el cartílago dañado.
Este tratamiento se conoce como implantación de condrocitos autólogos inducidos por la matriz (MACI), que se utiliza desde el año 2000. Sin embargo, desde 2014, la licencia de la planta de la UE para este medicamento de terapia avanzada MACI ha sido revocada, ya que el titular de la autorización de comercialización ha cerrado esta planta de la UE. Esto significa que actualmente esta terapia no está disponible para nuevos pacientes en la UE hasta que se registre un nuevo centro de fabricación en la UE.
iPSC
Las iPSC son células somáticas adultas, derivadas de la piel o la sangre, que se reprograman genéticamente en células pluripotentes de tipo embrionario. Esto permite una fuente ilimitada de todo tipo de células para su uso en la ingeniería de tejidos.
Holoclar es un producto de ingeniería tisular aprobado por la EMA. Se toman células autólogas del limbo y se cultivan en andamios para formar células corneales. Estas células de ingeniería tisular se implantan entonces en el ojo del paciente, donde sustituirán la superficie corneal dañada.
Conclusión: la terapia celular es prometedora en diferentes campos de la medicina
La terapia celular incluye diversas PTA en las que se manipulan células, derivadas de fuentes autólogas, alogénicas o xenogénicas, tras lo cual se administran (mediante infusión o inyección) al paciente. La ingeniería tisular ofrece la posibilidad de crear construcciones funcionales que puedan sustituir a un tejido.
Las células más utilizadas en los tratamientos de terapia celular son las células T, las células B, las células NK y las DC. Se trata de uno de los tratamientos más prometedores contra varios tumores, por lo que hay que seguir explorando y estudiando esta rama de la sanidad.
¿Quiere saber más sobre este tema, o sobre los ATMP en general? Contacte con el equipo de ATMP en QbD para ayudarle con cualquier cuestión relacionada con los ATMP.
- Medicamentos de terapia avanzada: Visión general | Agencia Europea de Medicamentos (europa.eu)
- Recuento de glóbulos blancos – Recuento sanguíneo completo (rnceus.com)
- Utilización de células xenogénicas como agente terapéutico para tratar enfermedades (sagepub.com)
- ATMP – ¿Qué son los ATMP? (atmpsweden.se)
- Qué son los ATMP 170620 (atmpsweden.se)
- Tipos de trasplantes de células madre y médula ósea (cancer.org)
- Visión general de la sangre y sus componentes – Enciclopedia de la salud – University of Rochester Medical Center
- Preguntas frecuentes sobre la terapia génica y celular | ASGCT – Sociedad Americana de Terapia Génica y Celular
- Introducción a la terapia con células madre (nih.gov)
- Glosario de Hematología – Hematology.org
- La biología de las células dendríticas y su papel en la inmunoterapia tumoral – PubMed (nih.gov)
- Terapia con células dendríticas | Tratamientos | Infusio.org
- Componentes de la sangre (artículo) | Khan Academy
- CAR T y TCR para el mercado: estado actual y perspectivas de futuro – Quality by Design (qbd.eu)
- Terapia de transferencia de células T – Inmunoterapia – National Cancer Institute
- Terapia celular adoptiva: CAR T, TCR, TIL, NK – Instituto de Investigación del Cáncer (IRC)
- La terapia con células T CAR y sus efectos secundarios (cancer.org)
- Terapia celular adoptiva con células asesinas naturales modificadas | Trasplante de médula ósea (nature.com)
- Perspectivas del tratamiento con linfocitos infiltrantes de tumores sólidos | BMC Medicine | Texto completo (biomedcentral.com)
- Inmunoterapia contra el cáncer basada en células B – Texto completo – Medicina Transfusional y Hemoterapia 2019, Vol. 46, nº 1 – Editorial Karger
- Situación actual y perspectivas de los ensayos de terapia celular CAR-T y CAR-NK en Alemania | Terapia génica (nature.com)
- Inmunoterapia con linfocitos infiltrados en el tumor para pacientes con melanoma metastásico – Full Text View – ClinicalTrials.gov
- Prueba diferencial de la sangre: Enciclopedia Médica MedlinePlus
- Cartílago de ingeniería tisular derivado de células autólogas para la reparación de lesiones de cartílago articular en la rodilla: protocolo de estudio para un ensayo controlado aleatorio | Ensayos | Texto completo (biomedcentral.com)
- Visión general de la ingeniería de tejidos (verywellhealth.com)
- Principios de ingeniería de tejidos – Google Boeken
- Células madre mesenquimales e ingeniería de tejidos (nih.gov)
- Células madre pluripotentes inducidas (iPS) | Centro de Células Madre de la UCLA
- Implantación de condrocitos autólogos inducidos por la matriz (MACI): evaluación biológica e histológica – PubMed (nih.gov)
- Maci | Agencia Europea de Medicamentos (europa.eu)
- Holoclar | Agencia Europea de Medicamentos (europa.eu)Los patrones de los subconjuntos de células dendríticas y monocitos se asocian con la gravedad de la enfermedad y la mortalidad en pacientes con cirrosis hepática | Scientific Reports (nature.com)