Entre los medicamentos de terapia avanzada (ATMP), en el mercado de la inmunoterapia, hoy en día dos siglas llaman la atención: CAR-T y TCR-T. Las dos técnicas se basan en la inserción de un receptor específico en las células T para permitirles detectar y matar específicamente las células tumorales. Cuando el receptor es el resultado de las combinaciones o parte de los receptores procedentes de los linfocitos B y T, hablamos de un CAR, Chimeric Antigen Receptor. En cambio, cuando el receptor es un receptor T específico para un determinado antígeno, se habla de TCR, receptor de células T. Ambas tecnologías pertenecen al campo de la terapia génica y celular. La CAR-T es históricamente una técnica bien establecida, aprobada por la FDA, con algunos productos ya disponibles en el mercado. En la última década, surgió la tecnología TCR-T. A pesar de compartir la base del proceso, las dos tecnologías presentan varias diferencias inmunológicas, moleculares y terapéuticas. En este artículo se explicarán los diferentes aspectos de estas dos técnicas y las expectativas y predicciones del mercado.
General
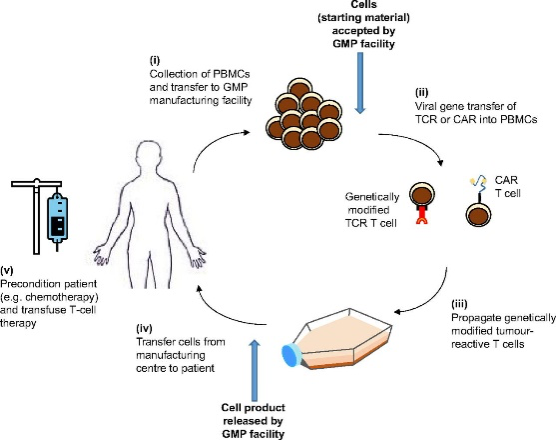
Tanto las técnicas CAR-T como las TCR se basan en un proceso de fabricación similar (Figura 1). En resumen, el material de aféresis del paciente se recoge en el hospital y se envía al centro de fabricación. Las células T CD8+ se aíslan, se activan (sólo en el caso del TCR), se transducen mediante un vector viral con el gen de interés, se expanden y se reinfunden en el paciente (Figura 1). Las células T CD8+ transducidas, que expresan un receptor específico (gen de interés), permiten el reconocimiento de marcadores de superficie específicos del tumor para iniciar una respuesta inmunitaria contra las células tumorales.
Si quiere tener una visión más profunda de la ATMP, haga clic aquí para visitar nuestra entrada de blog dedicada.
Diferencias entre CAR-T y TCR-T:
Al observar el proceso de fabricación, uno puede preguntarse por qué ambas técnicas coexisten y se siguen explorando para su comercialización. El secreto está en la aplicación y la eficacia probada de la misma. Las CAR-T están aprobadas por la FDA y son muy eficaces contra los tumores sanguíneos, las TCR están actualmente en ensayos clínicos y muestran una mayor eficacia contra los tumores sólidos en comparación con las CAR-T.
La tabla 1 ofrece un resumen de las diferencias más destacadas entre las técnicas CAR-T y TCR-T. Las diferencias mostradas hacen que las dos técnicas sean complementarias, y está dirigiendo el desarrollo del TCR hacia los tumores sólidos.
Tabla 1: Resumen de las diferencias entre las terapias CAR-T y TCR.
| CAR T | TCR | |
| Reconocimiento | Basado en antígenos de superficie | MHC en las células presentadoras de antígenos |
| Receptor | Quimera que combina las partes de reconocimiento y activación en un receptor de superficie | Nativo aunque específico para un antígeno |
| Especificidad | Bajo | Alta |
| Estado de la FDA | Terapia aprobada para múltiples formas de cáncer | Todavía en fase de ensayo clínico, pendiente de aprobación |
| Actividad | Tumores sanguíneos neoplasias hematológicas | Tumores sólidos |
El inicio de la investigación de las terapias CAR-T nos enseñó que podemos instruir y potenciar la capacidad de nuestro sistema inmunitario para combatir los tumores, lo que condujo en una etapa posterior al desarrollo de las TCR-T. De los 84 ensayos clínicos con TCR en 2018, el 84% se dirigían a tumores sólidos, posiblemente porque la CAR-T ya tiene una eficacia bien probada en el tratamiento de las neoplasias hematológicas, mientras que se demostró que no tenía éxito en los tumores sólidos.
La comercialización de las terapias con células T cobra impulso
Tras el éxito de los ensayos clínicos tanto de CAR-T como de TCR-T y la aprobación por parte de la FDA/EMA de múltiples terapias CAR-T, la comercialización de células T está en auge en todo el mundo. Muchas empresas sanitarias que históricamente no trabajaban con tecnologías de células T, ahora están adquiriendo los conocimientos y el equipo, abriendo nuevos centros y adquiriendo las aprobaciones gubernamentales necesarias, centrándose en asociaciones, adquisiciones y fusiones. El uso de la asociación, la adquisición y las fusiones se hace bien para alcanzar a los competidores que ya poseen las infraestructuras y los conocimientos técnicos necesarios, o simplemente para ampliar la capacidad de producción y la cartera de tratamientos. Entre los ejemplos europeos recientes están Lonza que compró Pharmacell en los Países Bajos en 2017, Bayer que compró la estadounidense Bluerock Therapeutics por mil millones de dólares en 2019 y más recientemente Catalent que compró Masthercell en Bélgica este año (2020).
Las proyecciones actuales de Estados Unidos prevén un crecimiento del mercado de células T de 2.380 millones de dólares en 2018 a 8.370 millones de dólares en 2027, con una tasa de crecimiento anual cercana al 15%. Mientras que el mercado mundial de la terapia génica contra el cáncer prevé una tasa de crecimiento anual del 32,5%. Aunque los Estados Unidos y el Reino Unido albergan a los actores más destacados de este mercado, la zona de Asia-Pacífico está avanzando rápidamente en su industria sanitaria. Si combinamos esto con el aumento del número de pacientes con cáncer en China e India, podemos entender que habrá un impulso hacia una cuota de mercado significativa en esa zona.
En cuanto a los usuarios finales, se espera que las clínicas y los centros ambulatorios crezcan a un ritmo cercano al del mercado (13%). Asimismo, se espera que los hospitales crezcan a un ritmo del 15% anual, alcanzando una cuota de mercado del 50% en 2027, gracias a un mayor número de pacientes y a la inversión en I+D en oncología.
Desafíos para la comercialización:
Los retos en este campo son múltiples desde varias perspectivas. Una reciente encuesta realizada entre 243 empresas del sector de los medicamentos antimicrobianos en Europa, identificó los principales problemas. Los principales retos destacados por la encuesta fueron los reglamentarios, los de fabricación y los científicos. Los retos normativos provienen principalmente del proceso. A menudo se trata de OGM, y se requieren estrictas medidas de control en varias etapas para cumplir con las normas de GMP. Los desafíos técnicos están relacionados con la fabricación y sus requisitos en términos de espacio y las dificultades en la aplicación de la garantía de calidad. Los retos científicos se centran principalmente en las dificultades encontradas durante el diseño de los ensayos. Además, desde el punto de vista del desarrollo, encontrar nuevos antígenos es un problema en términos de coste y fabricación. Otro gran reto son los diferentes niveles de desarrollo y fabricación. Una parte sólida de la actividad de I+D se realiza a nivel universitario o se lleva a cabo en spin-off, dentro del entorno académico. La consecuencia directa es la falta de regulación a este nivel y la falta de infraestructura para la producción. Cuando el producto está listo para su fabricación, se contacta con una OCM para la producción a gran escala. Estos productos plantean muy a menudo un reto de traslación durante la fase de transferencia de tecnología. Se desarrollan en un entorno normativo limitado y se fabrican dentro de la estricta normativa GMP. Este desajuste puede llevar a detener la transferencia de tecnología y a retroceder a la fase de desarrollo del producto, con el consiguiente aumento de tiempo y costes. (Si quiere saber más sobre la comercialización de los ATMP , visite nuestro blog sobre los principales obstáculos que hay que salvar para la comercialización de los ATMP.
Una solución podría ser un enfoque basado en el riesgo que identifique por adelantado los puntos críticos y permita abordarlos durante la fase de desarrollo. La transferencia de tecnología comenzará con un proceso sólido ya diseñado para ser escalable y con un alto grado de automatización. Nuestra plataforma de software CbD combina los puntos anteriores para ayudar en el desarrollo y la comercialización de ATMPs. Nuestro objetivo final es reducir el tiempo de I+D a la fabricación, permitiendo que esta prometedora tecnología llegue al mercado con precios asequibles.
Si quiere saber más sobre la transferencia de tecnología, visite nuestro blog dedicado.
Referencias:
«El emergente mundo de los ensayos con células TCR-T contra el cáncer: Una revisión sistemática» – Tecnología en investigación y tratamiento del cáncer – 2019
«El mercado de las terapias con células T alcanzará los 8.370 millones de dólares en 2027» – Informes y Datos 2019
«Tamaño del mercado de la terapia celular CAR-T – Análisis detallado de las cifras actuales de la industria con previsiones de crecimiento para 2026» – 2020
(Imagen) gene_therapy_cellular_therapy_gsk_miltenyi_biotec_manufacturing_gmp_cancer_leukemia
«Diferencia entre CAR-T y TCR-T» – www.differencebetween.com
«Lonza cubre la brecha de fabricación de terapia celular y génica en la UE mediante la compra de PharmaCell» – w ww.biopharma-reporter.com – 2017
«Bayer compra BlueRock en una apuesta de 600 millones de dólares por las terapias con células madre» – www.reuters.com – 2019
«Catalent completa la adquisición de MaSTherCell» – www.catalent.com/catalent-news – 2020