La gestión de riesgos es clave para promoveren la seguridad de f dispositivos médicos . Así que es con razón que la nueva europeo reglamentos sobre productos sanitarios MDR e IVDR (reglamentos de la UE Reglamento (UE) 2017/745 y 2017/746) hacen hincapié en este aspecto. Al contrario que las directivas sobre productos sanitarios‘ (MDD, AIMDD, IVDD) la vaguedad en la materia, el MDR y IVDR abordan los requisitos de gestión de riesgos muy específicamente.
"Muchos siguen creyendo que un AMFE marca la casilla de la gestión de riesgos".
No obstante, por muy crucial que sea la gestión de riesgos de los productos sanitarios, su implementación y posterior aplicación son no siempre son sencillas. Muchos todavía ven la gestión de a gestión del riesgo es una obligación tarea und creen que un FMEA (Failure Mode and Efecto Efecto) marca la caja. Sin embargo, este no cumple con lo que la normativa espera.
Reglamento sobre productos sanitarios (MDR)
Según el MDR (Reglamento (UE) 2017/745), «la gestión de riesgos se entenderá como un proceso iterativo continuo a lo largo de todo el ciclo de vida de un producto, que requiere una actualización sistemática periódica«.
Tenga en cuenta que esta sección sólo habla de los requisitos señalados en el MDR, pero los requisitos señalados en el IVDR (Anexo I – Requisitos generales de seguridad y rendimiento – Capítulo I) son iguales.
El marco – en términos de gestión de riesgos requisitos de gestión de riesgos – se describe en los requisitos generales de seguridad y rendimiento (GSPR) en el Anexo I del MDR y establece que los fabricantes deberán:
- establecer y documentar un plan de gestión de riesgos para cada dispositivo;
- identificar y analizar los peligros conocidos y previsibles asociados a cada dispositivo;
- estimar y evaluar los riesgos asociados y que se producen durante el uso previsto y durante un mal uso razonablemente previsible;
- eliminar o controlar estos riesgos
- evaluar el impacto de la información procedente de la fase de producción y, en particular, del sistema de vigilancia posterior a la comercialización, sobre los peligros y la frecuencia de su aparición, sobre las estimaciones de sus riesgos asociados, así como sobre el riesgo global, la relación beneficio-riesgo y la aceptabilidad del riesgo; y
- basándose en la evaluación del impacto de esta información, modificar las medidas de control si es necesario.
El cumplimiento de la normativa es mucho más que un AMFE
El AMFE es probablemente la herramienta de gestión de riesgos más extendida en el ámbito de la DM. Teniendo sólo un FMEA (o incluso varios FMEAs) en su lugar no no hace que se cumpla la normativa indicada.
¿Por qué? Por ejemplo, un FMEA examina los riesgos relacionados con los fallos, mientras que también puede esperar identificar y analizar los peligros durante el uso normal previsto del producto sanitario. Los riesgos asociados a un producto sanitario no son exclusivamente el resultado de fallos. Un dispositivo puede seguir poniendo en riesgo a los pacientes mientras funciona normalmente.
"Se espera que empiece con la gestión de riesgos al inicio del proceso de diseño y desarrollo".
Además, durante un AMFE se analizan, por ejemplo, los componentes del dispositivo (AMFE de diseño) o su proceso de fabricación (AMFE de proceso). Por lo tanto, su diseño o proceso debe estar ya bastante maduro. Y, en consecuencia, este análisis se realiza en una etapa posterior de su trayectoria de desarrollo.
Sin embargo, se espera que comience con la gestión de riesgos al inicio del proceso de diseño y desarrollo. En consecuencia, los resultados o las medidas de control de riesgos pueden aplicarse ya durante la trayectoria de diseño y desarrollo. Se utilizarán como insumos de diseño.
Los AMFE son herramientas muy potentes y útiles, pero hay que tener en cuenta que son un componente de un sistema de gestión de riesgos más amplio. ¿Qué aspecto tiene este sistema y cómo puede aplicarlo en su empresa? La norma ISO 14971 (aplicación de la gestión de riesgos a los productos sanitarios) le ofrece una respuesta.
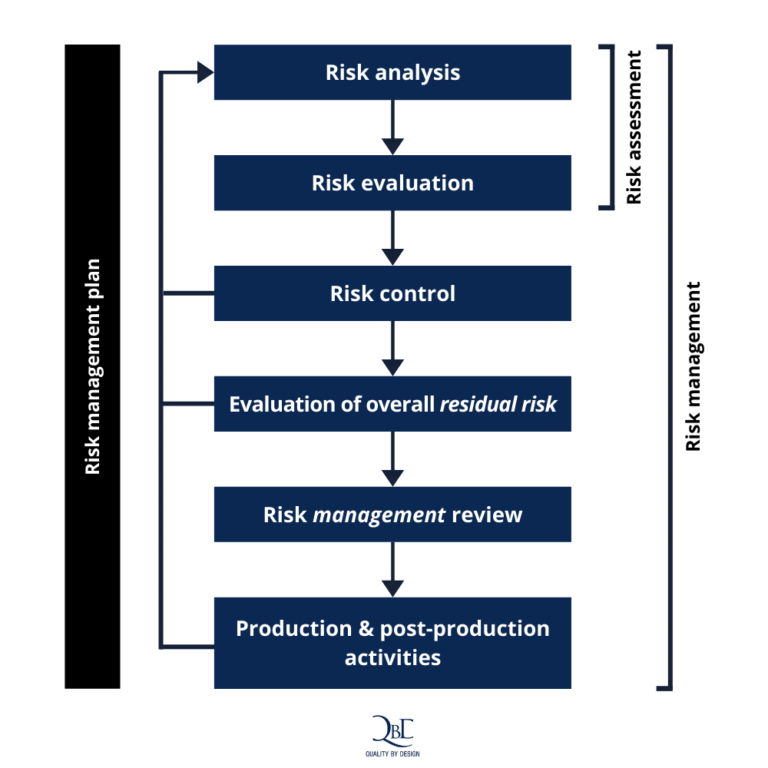
Figura 1 – Representación esquemática del proceso de gestión de riesgos
Norma de gestión de riesgos ISO 14971:2019
ISO 14971 es la norma mundial para la gestión de riesgos de los productos sanitarios. Proporciona un marco en el que la experiencia, la perspicacia y el juicio se aplican sistemáticamente para gestionar los riesgos asociados al uso de productos sanitarios. Los requisitos descritos en esta norma son aplicables a todas las fases del ciclo de vida de un producto sanitario.
La versión más reciente se publicó en diciembre de 2019, ISO14971:2019. Seis meses más tarde, le siguió el documento de orientación relacionado ISO/TR 24971:2020-06. Esta guía puede considerarse como un largo comentario, ya que concreta larequisitos de la norma ISO 14971 y ofrece asistencia a los fabricantes de productos sanitarios para su aplicación.
Las primeras treinta páginas comentan la ISO 14971:2019 capítulo por capítulo. Le siguen 8 apéndices de 55 páginas. El siguiente cuadro muestra el contenido de ambos documentos.
ISO 14971:2019
- Alcance
- Referencias normativas
- Términos y definiciones
- Requisitos generales del sistema de gestión de riesgos
- Análisis de riesgos
- Evaluación de riesgos
- Control de riesgos
- Evaluación del riesgo residual global
- Revisión de la gestión de riesgos
- Actividades de producción y postproducción
Además:
- Anexo A – Justificación de los requisitos
- Anexo B – Proceso de gestión de riesgos para productos sanitarios
- Anexo C – Conceptos fundamentales de riesgo
ISO/TR 24971:2020
Las secciones 1-10 se corresponden con la norma ISO14971:2019
Además:
- Anexo A – Identificación de los peligros y las características relacionadas con la seguridad
- Anexo B – Técnicas de apoyo al análisis de riesgos
- Anexo C – Relación entre la política, los criterios de aceptabilidad del riesgo, el control del riesgo y la evaluación del riesgo
- Anexo D – Información para la seguridad e información sobre el riesgo residual
- Anexo E – Papel de las normas internacionales en la gestión de riesgos
- Anexo F – Orientaciones sobre los riesgos relacionados con la seguridad
- Anexo G – Componentes y dispositivos diseñados sin utilizar la norma ISO 14971
- Anexo H – Orientaciones sobre productos sanitarios para diagnóstico in vitro
"La norma ISO 14971:2019 representa la actual estado de la técnica para la gestión de riesgos".
El ISO 14971:2019 norma fue no estaba armonizada cuando este blog fue publicado. Por lo tanto, conformidad con estasta norma es actualmente no es obligatorio para el marcado CE de los productos sanitarios según la normativa europea sobre productos sanitarios (IVDR y MDR).
No obstante, ISO 14971:2019 representa la actual estado de la técnica para la gestión de riesgos. Por lo tanto, su aplicación – desde el inicio del proceso de desarrollo del dispositivo en adelante – es considerado clave a la hora de implantar un proceso de gestión de riesgos en una empresa de MD.
A lo largo de todo el ciclo de vida
La normativa sobre productos sanitarios (MDR e IVDR) impone un proceso continuo e iterativo de gestión de riesgos a lo largo de todo el ciclo de vida de un producto. La norma ISO 14971:2019 y el documento de orientación que la acompaña establecen dicho marco de gestión de riesgos.
No obstante, sigue siendo un proceso complejo con muchas consideraciones. En QbD, podríamos hablar de la gestión de riesgos todo el día. Así que si quiere más información, estamos aquí para usted. No dude en ponerse en contacto con nosotros.
