Productos farmacéuticos combinados
Las vías reglamentarias puede parecer a menudo un laberinto, que provoca incertidumbre y posibles escollos en el proceso de presentación. Más aún cuando se trata de productos farmacéuticos combinados. No hay nada más descorazonador que invertir mucho tiempo y recursos en desarrollar tu producto, sólo para enfrentarte al rechazo de las autoridades reguladoras debido a expectativas poco claras o a que datos insuficientes.
En QbD Group ofrecemos soluciones integrales para navegar por el complejo proceso de registro de estos productos innovadores tanto en la Unión Europea (UE) como en Estados Unidos (EE.UU.).

Europa
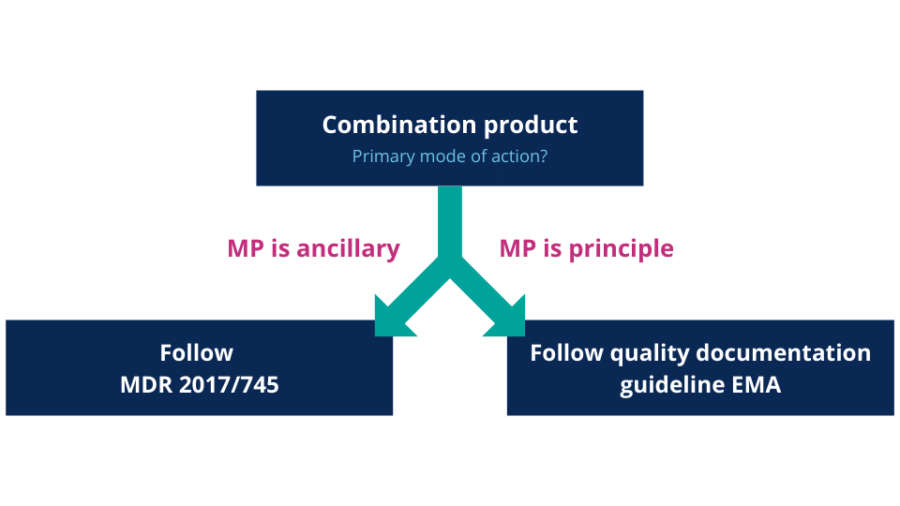
1. Determinación del modo primario de acción (PMOA):
Define si tu producto es principalmente un producto sanitario o un medicamento para seguir la vía reglamentaria adecuada.
2. Determinar la vía adecuada
Si el medicamento es auxiliar, tu producto combinado debe desarrollarse de conformidad con el Reglamento (UE) 2017/745 (Reglamento sobre productos sanitarios). Si el medicamento es principio, está regulado por la Directiva sobre medicamentos (Directiva 2001/83/CE).
Vía reglamentaria para los productos combinados de productos sanitarios.
El organismo notificado debe solicitar a la EMA un dictamen científico sobre la calidad, seguridad e idoneidad del excipiente en tres casos:
- si el excipiente procede de sangre o plasma humanos;
- si ha sido evaluada previamente por la EMA;
- si entra en el ámbito obligatorio del procedimiento centralizado.
Para otras sustancias, el organismo notificado puede solicitar el dictamen de la autoridad nacional competente o de la EMA, por ejemplo, en los casos en que la EMA ya haya evaluado un medicamento que contenga la misma sustancia medicinal.
Vía reglamentaria para los medicamentos combinados.
Diferentes tipos de medicamentos.

Medicamentos integrados/coenvasados:
Cuando un producto complejo se clasifica como medicamento, hay que seguir una normativa específica en función de su tipo.
Guía del proceso normativo. El diagrama de flujo que figura a continuación describe los pasos necesarios para obtener todos los documentos y certificados de calidad requeridos, basándose en las directrices para la documentación de calidad de los medicamentos utilizados con un producto sanitario.

EE.UU.
1. Identificar el centro de la FDA que tendrá jurisdicción primaria para la revisión y regulación previa a la comercialización
- Depende del PMOA
- Si es necesario, ayuda con un RFD
2. Identifica el tipo de solicitud de investigación (IND o IDE)
Debes tener en cuenta los requisitos normativos sobre cuándo se requiere una solicitud de nuevo fármaco en investigación (IND) o una solicitud de exención de dispositivo en investigación (IDE) a la hora de determinar si es necesaria una solicitud de investigación para un producto combinado, y tener en cuenta cada parte constituyente, así como el producto combinado, a la hora de tomar estas determinaciones. Normalmente, se presenta un IND si el producto combinado tiene un PMOA de fármaco o biológico y un IDE si el producto combinado tiene un PMOA de dispositivo.
3. Identificar la aplicación de Marketing
Los productos combinados suelen comercializarse con un tipo de autorización de comercialización asociado al componente que proporciona el modo de acción primario (PMOA) del producto combinado (es decir, una solicitud de nuevo fármaco (NDA) o una solicitud abreviada de nuevo fármaco (ANDA) si tiene un PMOA farmacológico, una solicitud de licencia biológica (BLA) si tiene un PMOA biológico, o una solicitud de aprobación previa a la comercialización (PMA) de certificación de novo, o una notificación previa a la comercialización («510(k)») si tiene un PMOA de dispositivo). Una única solicitud de comercialización suele ser suficiente para un producto combinado. En algunos casos, sin embargo, un patrocinador puede desear presentar solicitudes de comercialización separadas para las distintas partes constituyentes de un producto combinado, y la FDA puede considerarlo permisible.
Cómo podemos ayudarte
- Te ayudamos a elegir el procedimiento adecuado para tu producto.
- Asesoramiento sobre la estrategia reguladora.
- Gestión combinada del ciclo de vida del producto.
- QbD group contamos con amplios conocimientos normativos, lo que garantiza vías eficientes de comercialización al tiempo que se cumplen los estrictos requisitos normativos.
- Brindamos apoyo integral abarca el desarrollo de productos combinados, desde el concepto hasta el lanzamiento al mercado.
¿Por qué QbD Group?
Benefíciate de nuestro equipo de asesores altamente cualificados.
Apoyo completo desde la fase previa a la comercialización hasta la fase posterior.
QbD Group opera a escala mundial, con oficinas estratégicamente situadas en Europa y Sudamérica. Esta amplia red nos permite ejecutar proyectos de forma eficiente en diversos lugares del mundo.
Evaluación constante, transparencia y objetivos claros.
Contacta con nosotros
Póngase en contacto con nosotros para obtener más información o para solicitar una propuesta gratuita y sin compromiso.
