Procedimientos reglamentarios
Hay varios procedimientos para registrar medicamentos farmacéuticos, según el tipo de medicamento y la vía de comercialización que pretendas utilizar. Desde QbD Group podemos asesorarte y correr contigo el camino.

Procedimientos reglamentarios en la UE y el Reino Unido

Hay varios procedimientos disponibles para registrar medicamentos farmacéuticos en la UE y el Reino Unido. El método elegido depende del tipo de medicamento (de venta libre – Medicamentos sin receta – Rx, Genéricos, nuevas entidades químicas, productos derivados de la biotecnología, …) y la vía de comercialización prevista.
La legislación europea prevé determinados procedimientos para determinados tipos de productos, por ejemplo, el procedimiento centralizado es obligatorio para los productos derivados de la biotecnología, los medicamentos huérfanos y los medicamentos destinados a determinados grupos de enfermedades, como el SIDA, el cáncer, los trastornos neurodegenerativos y la diabetes. Otros productos pueden registrarse por la vía nacional o utilizando uno de los procedimientos europeos (Procedimiento de Reconocimiento Mutuo (PRM) o el Procedimiento Descentralizado (PDC)).
Nuestro equipo, con sede en el Reino Unido, también puede ayudarte con las solicitudes nacionales del Reino Unido/GB y el procedimiento de reconocimiento internacional.
Por último, nuestros expertos también pueden ayudarte a introducir tus medicamentos en el mercado estadounidense.
Procedimiento nacional
Si un solicitante desea obtener una licencia en un Estado Miembro (EM), debe presentar una solicitud a la Autoridad Competente (AC) nacional, que a su vez expide una licencia nacional. Desde 1998, las licencias nacionales se limitan estrictamente a la fase inicial del Reconocimiento Mutuo.
Extensiones de línea
El Reglamento (CE) nº 1084/2003 (MRP o DCP) y el Reglamento (CE) nº 1085/2003 (para CP) describen en el anexo II los tipos de solicitudes que quedan fuera del ámbito de las «modificaciones», pero que al mismo tiempo no son solicitudes nuevas completas. El anexo II enumera tres categorías principales para los productos autorizados existentes con:
- Cambios en la sustancia activa
- Cambios en la potencia, forma farmacéutica y vía de administración
- Otros cambios específicos de los medicamentos veterinarios que se administran a animales destinados a la producción de alimentos
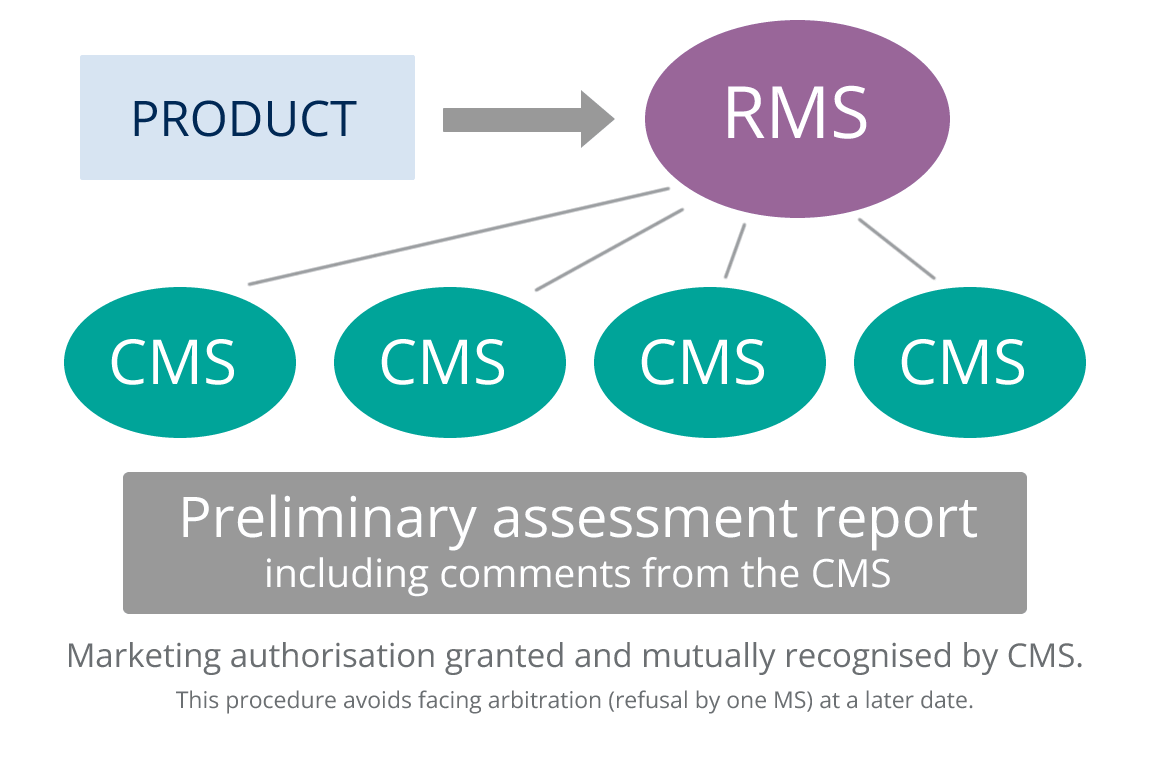
Procedimiento de reconocimiento mutuo (PRM)
Para los productos que deban registrarse en más de un Estado miembro (EM ) y que no puedan acogerse al Procedimiento Centralizado (PC), los solicitantes deben utilizar el Procedimiento Descentralizado (DCP ) o el Procedimiento de Reconocimiento Mutuo (MRP). El MRP debe utilizarse si el objetivo es registrarse en más de un Estado miembro y el medicamento en cuestión ya ha recibido una Autorización de Comercialización (AC) en cualquier EM en el momento de la solicitud.
El MRP se basa en la idea de que una licencia nacional aprobada en un Estado miembro de la UE (Estado miembro de referencia – EMR) debe ser reconocida mutuamente en otros países de la UE (Estados miembros afectados – EMC). Esto se basa en el supuesto de que los criterios de evaluación en los Estados miembros de la UE están suficientemente armonizados y tienen el mismo nivel. Al final de un MRP se emiten licencias nacionales en los CMS implicados en el procedimiento.
La armonización a lo largo del ciclo de vida del producto se garantiza mediante la aplicación de variaciones (detalladas en el Reglamento (CE) nº 1084/2003) simultáneamente en el RMS y en los CMS. Para ello, el titular de la autorización de comercialización (TAC) debe asegurarse de que dispone de los recursos necesarios para lograr esta presentación simultánea en todos los países implicados en el PRM.
Procedimiento descentralizado
El Procedimiento Descentralizado (DCP), en general, sigue los mismos principios del MRP. Una licencia aprobada en un Estado miembro (EM) debe ser reconocida mutuamente en otros Estados miembros (EM), suponiendo que los criterios de evaluación en los Estados miembros de la UE estén suficientemente armonizados y tengan el mismo nivel. El DCP debe utilizarse si el objetivo es obtener una autorización de comercialización en varios Estados miembros (EM) cuando, en el momento de la solicitud, el medicamento en cuestión aún no haya recibido una autorización de comercialización en ningún EM. La principal diferencia entre el MRP y el DCP radica en que los Estados Miembros Interesados (EMI) en un DCP participan al inicio del procedimiento, a diferencia de esperar a la aprobación antes de presentar una solicitud en el EMI.
Procedimiento centralizado
Para obtener una Autorización Comunitaria, se presenta una solicitud a la EMEA – Agencia Europea de Medicamentos. El Comité de Medicamentos de Uso Humano (CHMP) o el Comité de Medicamentos de Uso Veterinario (CVMP) evalúan científicamente la solicitud. La Comisión Europea recibe un dictamen en un plazo de 210 días y elabora un proyecto de decisión sobre una AM comunitaria. Una AM concedida en virtud del PC es válida para todo el mercado de la UE.
El Procedimiento Centralizado (PC) tiene mandato para:
- Productos biotecnológicos
- Medicamentos huérfanos y
- Medicamentos que contienen un nuevo principio activo destinado a tratar el síndrome de inmunodeficiencia adquirida (SIDA), el cáncer, los trastornos neurodegenerativos y la diabetes
- Productos terapéuticamente innovadores
- Productos OTC con un claro valor añadido para la comunidad
- Algunos productos genéricos
Referencias:
Documento: Notificación al solicitante, Vol 2A, Capítulo 1 «Autorización de comercialización», 2005.
Documento: Notificación al solicitante, Vol 2A, Capítulo 2 – Reconocimiento mutuo (versión actualizada – febrero de 2007)
Documento: Notificación al solicitante, Vol 2A, Capítulo 4 – Procedimiento centralizado (versión actualizada – Avril 2006)
Reglamento (CE) nº 1085/2003 de la Comisión, de 3 de junio de 2003
Reglamento (CE) nº 1084/2003 de la Comisión, de 3 de junio de 2003
Cómo podmeos ayudarte
- Encontramos el procedimiento adecuado para el registro de tu producto.
- Asesoramiento sobre la regulación.
- Te ponemos contacto con las autoridades nacionales competentes.
- Te ayudamos a organizar y dirigir las reuniones con las agencias.
- Hacemos un seguimiento de tu solicitud hasta el registro.
¿Por qué QbD Group?
Benefíciate de nuestro equipo de asesores altamente cualificados.
Apoyo completo desde la fase previa a la comercialización hasta la fase posterior.
QbD Group opera a escala mundial, con oficinas estratégicamente situadas en Europa y Sudamérica. Esta amplia red nos permite ejecutar proyectos de forma eficiente en diversos lugares del mundo.
Evaluación constante, transparencia y objetivos claros.
Contacta con nosotros
Póngase en contacto con nosotros para obtener más información o para solicitar una propuesta gratuita y sin compromiso.
