Objetivo de la Validación de Limpieza
Es crucial entender lo que significa validar la limpieza, al igual que como debe hacerse, que áreas o equipos requieren de validación de limpieza y cuál es la manera correcta de documentarlo. Todo lo anterior lo explicaremos a detalle en este blog.
¿Qué es la validación de limpieza?
Permite tener confianza en los procesos de limpieza que se desarrollan dentro de la empresa protegiendo la integridad del producto, cumpliendo con la normatividad, evitando la contaminación cruzada y proliferación microbiológica. La validación de limpieza se hace para asegurar la reducción de residuos contaminantes con el fin de preservar la salud del paciente.

¿Por qué se deben validar los procesos de limpieza?
Porque de esta manera se asegura el control en la contaminación cruzada generada por residuos del proceso.
¿Debo tener un procedimiento?
Deben existir procedimientos escritos de limpieza y desinfección que describan con detalle los horarios de limpieza, métodos, equipos y materiales que se usaran en las instalaciones, equipos y objetos a limpiar.
Adicionalmente se debe monitorear regularmente la presencia de microorganismos lo cual debe estar especificado en el procedimiento, que tipo de microorganismos se monitorean y cada cuanto se realiza el control. (Resolución 1160,2016).
Así como en la guía ISO14644 se debe seguir como guía para la clasificación de áreas de acuerdo con la concentración de partículas en el aire que debe monitorearse para áreas limpias.
En Qbd Digital podrás encontrar todos los documentos requeridos para realizar tú Validación de Limpieza y te reducirá el 70% del tiempo en el desarrollo de documentación.
Aquí podrás ver todo lo que contiene.

¿Qué limpieza se debe validar?
Los siguientes son procedimientos de limpieza que deben validarse al tener GMP:
- Limpieza de material de vidrio.
- Limpieza de áreas
- Limpieza de equipos
- Limpieza de vestimenta
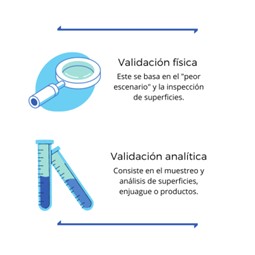
La validación de limpieza es un proceso por el cual se establece una evidencia documental de que el procedimiento de limpieza establecido reduce de manera constante los residuos generados en las diferentes superficies analizadas por lo tanto a un nivel normativamente aceptable.
Algunas de las definiciones importantes para la validación de limpieza son:
- Residuo: Conjunto de sustancias que quedan en el equipo después de su limpieza.
- Dosis terapéutica: Dosis diaria que logra un efecto terapéutico determinado
- Dosis toxica: Mínima dosis que produce un efecto adverso
- DL50: Dosis toxica que provoca la muerte del 50% de los animales inoculados
- CIP: Limpieza que se realiza sin desmontar ni trasladar el equipo.
- COP: Limpieza que se realiza desmontando el equipo y trasladándolo a otra zona.
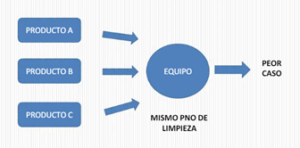
- Peor caso: Condición más desfavorable para un evento determinado.
- Equipo dedicado: Destinado a un solo producto.
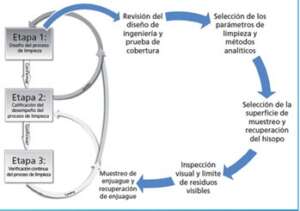
¿Como se hace una validación de limpieza?
Pasos que debes seguir
- Define el sistema a ser limpiado: Lo primero que debes hacer es definir a que le vas a realizar un procedimiento de limpieza previamente definido.
- Una vez seleccionado pasas a evaluar los siguientes requisitos:
- Definir los posibles contaminantes que tienes de acuerdo con el objeto y proceso involucrado.
- Realizar un análisis de riesgos con el fin de encontrar todos los riesgos asociados que conlleva realizar un mal procedimiento de limpieza.
- Definir el material que será usado para realizar la limpieza
- Definir el tipo de limpieza que se va a realizar
- Definir los parámetros que serán monitoreados y controlados.
- Una vez definido los requisitos anteriores, se define un plan de validación de limpieza, seguido de la realización de un protocolo que definirá el proceso de limpieza a validar y su ejecución, obteniendo finalmente un reporte de validación.
Recuerda que:
- El método de limpieza debe ir acorde con la naturaleza del producto
- Se debe contar con un programa para el uso de sanitizantes (el uso de sanitizantes debe ser validado).
- Se deben usar métodos analíticos validados para detectar las trazas de contaminantes, detergentes y/o sanitizantes.
- Seleccionar el peor caso basado en solubilidad, dificultad de limpieza, concentración y toxicidad ayuda a seleccionar un producto representativo.
- Se deben evaluar tres limpiezas consecutivas.
- La vigencia de la limpieza de los equipos, áreas, superficies y materiales debe establecerse con base en los resultados de la validación.
- Establecer un cronograma para la determinación de trazas.
El peor caso
El peor caso se puede seleccionar por características de formulación de los productos, por ejemplo: grupos de productos con excipientes similares en formulación y/o solubilidad de activos.
También se puede seleccionar un peor caso por uso de equipos, por ejemplo: si son equipos dedicados o multipropósito; o por equipos similares, por ejemplo: se tienen varios mezcladores en V de diferentes tamaños. Otra forma de seleccionar un peor caso es por el procedimiento de limpieza común.
Validación de limpieza en equipos
Para la validación de limpieza en equipos se debe tener en cuenta:
- Diseño del equipo (Material de construcción)
- Dedicación del equipo
- Superficie de contacto con producto
- Ubicación de puntos críticos (Puntos de muestreo)
¿Qué debe especificar el protocolo?
- Productos a analizar
- Método de análisis
- Hisopo a utilizar de ser necesario
- Técnica de muestreo
- Cantidad de solvente
- Manejo de muestras
- Preparación de las muestras
- Capacitación del personal
- Agentes de limpieza
- Calidad del agua a usar
- Diagrama de puntos de muestreo
- Criterios de aceptación
- Manejo de desviaciones
- Identificaciones de lotes
Referencias
- Ministerios de salud y protección social Resolución 1160 2016
- Guía para la Inspección de Validación del Proceso de Limpieza (FDA)
- ISO 14644-1 Areas limpias
- Organización mundial de la salud. 1998. Guía de la OMS sobre los requisitos de las prácticas adecuadas de fabricación (PAF)
En QbD Digital encontrarás todos los documentos requeridos para realizar tu validación de limpieza.
Aquí podrás ver todo lo que contiene
Cualquier duda informarnos al 📞: +57 311 5825314
