¿Qué es un sistema computarizado?
Es un conjunto de componentes interrelacionados que trabajan en conjunto, para realizar tareas específicas mediante el procesamiento de información. Están compuesto por Hardware y el Software, los cuales en conjunto procesan datos, realizan cálculos, almacenan información y ejecutan diversas funciones según las instrucciones programadas.
Estos pueden variar en escala y complejidad. Pueden ser desde dispositivos pequeños y especializados, como un termostato inteligente, hasta sistemas más grandes y complejos como aplicaciones encargadas de manejar y administrar cromatógrafos.
¿Qué es la validación de un sistema computarizados?
Es un proceso integral y sistemático que se crea con el fin de confirmar que el sistema cumple con los requisitos específicos del usuario, que opera de manera confiable y consistente en su entorno. Este procedimiento busca garantizar que el sistema cumpla con los estándares de calidad y cumpla con los objetivos para los cuales fue diseñado.
La validación de sistemas computarizados es obligatoria y esencial en entornos regulados, como la industria farmacéutica, la industria alimentaria y otros sectores donde la precisión y la integridad de los datos son críticas. Durante este proceso, se llevan a cabo pruebas exhaustivas para confirmar que el sistema funciona correctamente en diferentes situaciones y escenarios.
Los aspectos clave de la validación de sistemas computarizados incluyen la verificación del diseño del sistema, de la instalación del hardware y software, pruebas de rendimiento, pruebas de integridad de datos, y la documentación detallada de todo el proceso. Este enfoque garantiza la fiabilidad y la conformidad del sistema con los requisitos regulatorios y las normativas aplicables. Por lo cual validación de sistemas es un paso crucial para mitigar riesgos y asegurar la consistencia y precisión en el uso continuado del sistema.
¿Cuándo validar un sistema computarizado?
Un sistema computarizado se debe validar cuando, se utilice en una industria regulada como la farmacéutica y además tenga impacto en las BPX entendiendo X como:
- BPM Buenas prácticas de manufactura
- BPL Buenas prácticas de laboratorio
- BPD Buenas prácticos de distribución
- BPDe Buenas Prácticas de Desarrollo
- BPI Buenas Prácticas de Ingeniería
Además de esto se debe tener en cuenta la categorización del sistema para la validación de este, la cual puede seguir diferentes guías, donde la más utilizada y conocidas es la GAMP la cual los categoriza de la siguiente manera:
- Categoría 1 (software de infraestructura): Software usado para administrar entornos operativos. Ejemplo: Sistema operativos, base de datos, lenguajes de programación, software de oficina (office). Estos sistemas no deben validarse.
- Categoría 2: No usada en GAMP 5.
- Categoría 3 (Productos no configurables): Software que se utiliza con los valores predeterminados o proporcionados por el proveedor. Puede ingresarse y almacenarse información, pero NO puede adaptarse a las necesidades del Negocio.
- Ejemplo: Balanzas sencillas
- Categoría 4 (Productos configurables): Se puede configurar para que coincida con un proceso del negocio. Proporciona interfaces estándar y funciones que permiten la configuración de los procesos de negocios específicos de usuario. NO se altera el código del software
- Categoría 5 (Personalizadas): Están desarrollados para las necesidades específicas de la compañía.
Luego de categorización se debe tener un ciclo de vida aplicable a cualquier sistema y a su validación, que se adapte los entregables según la categoría GAMP. Donde al momento de inicio de la validación, se deben construir todos los entregables previos al proceso de implementación y operación como se indica en la siguiente imagen:
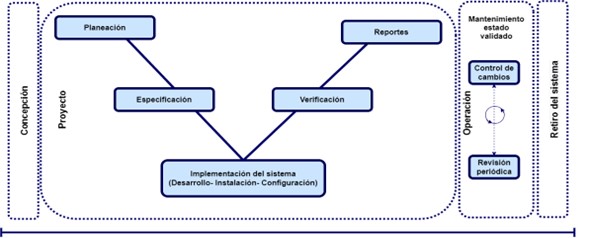
Para la construcción de los entregables que soporten la validación se debe tener en cuenta la metodología en V de entregables indicados por la guía GAMP, la cual se divide en cuatro etapas las cuales son:
- Planeación: En esta etapa se hace una evaluación de riesgos para la categorización del sistema, además la planeación de la validación.
- Especificación: En esta etapa se analizan todos los requerimientos del usuario, las especificaciones del sistema y se evalúan los riesgos si el sistema no cumple con alguno de los requerimientos o especificación estipulados.
- Verificación: En esta etapa se realiza la revisión y calificaciones (Diseño, Instalación, Operación y Desempeño) con el fin de mostrar que el sistema es funcional y eficiente para lo que se adquirió.
- Reportes. En esta etapa se realiza una matriz de trazabilidad con el fin de revisar que todos los requerimientos y especificaciones, se pusieron a prueba en las calificaciones correspondientes, además un reporte de validación, el cual indique, si se cumplió el objetivo, si se presentaron deviaciones o si en el proceso se tuvo que cambiar el alcance de la validación.
Estas cuatro etapas están ligadas al sistema y la cantidad de documentos a desarrollar depende la categoría de este, la cual está ligada a la categoría del sistema como se puede ver a continuación:
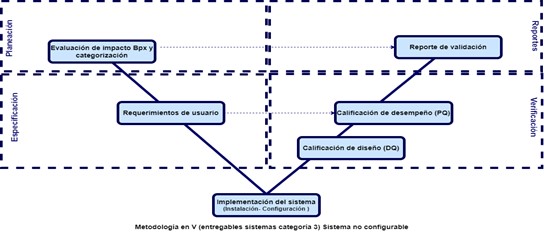
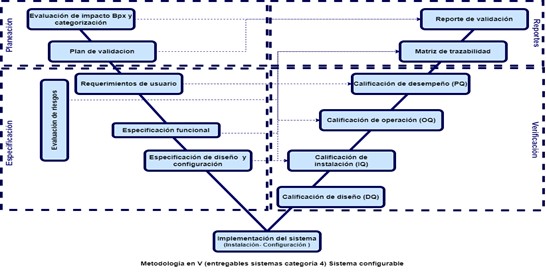
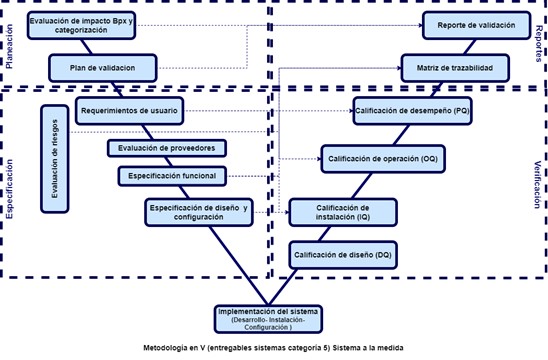
Hay que tener en cuenta algo muy importante que, para avanzar en cada etapa de la validación, se debe tener finalizada la etapa anterior (todos los documentos desarrollados, revisados y aprobados).
Te podría interesar
Contacta con nosotros
¿Necesitas ayuda con tu cualificación y validación? No dudes en ponerte en contacto.

