Validación de Métodos Analíticos
Autor | Erick Miranda
- ¿Sabes que es validación de métodos analíticos?
- ¿Por qué validar métodos analíticos?
- ¿Para qué validar los métodos analíticos?
- ¿Cuándo validar los métodos analíticos?
En este documento te vamos a resolver y explicar todo acerca de las preguntas anteriores, diferencias entre validación y verificación, además conocer los requisitos de las normas internacionales sobre la validación de métodos.
¿Qué es validación?
Es la confirmación mediante el suministro de evidencia objetiva de que se han cumplido los requisitos para una utilización o aplicación especifica prevista.
¿Qué es Verificación?
Confirmación mediante la aportación de evidencia objetiva de que se han cumplido los requisitos especificados.
¿Diferencias entre Validación y Verificación?
Al validar queremos tener la certeza de si un sistema logrará el resultado definido en un plan, todo esto a futuro y con posibilidad de que existan revalidaciones en el proceso. Al verificar estamos volviendo a repasar el funcionamiento del plan en el pasado o en el presente para poder tomar acciones.
¿Qué es validación de métodos analíticos?
Según USP, la validación de un método analítico es el proceso por el cual se establece, mediante estudios de laboratorio, que las características de desempeño del método cumplen con los requisitos para las aplicaciones analíticas previstas.
Según la FDA, la validación de métodos es el proceso por el cual se demuestra que los procedimientos analíticos son aptos para el uso indicado.
¿Por qué validar métodos analíticos?
Los métodos analíticos se validan para generar confianza, métodos reproducibles y confiables.
¿Para qué validar métodos analíticos?
Para cumplir con los requisitos de las normas internacionales, emitir resultados exactos y precisos.
Principales normas que hay que cumplir:
- BPM (Industria Farmacéutica).
- Norma ISO 17025 (Acreditación de Laboratorios de Ensayo y de Calibración).
- Norma ISO 15189 (Acreditación de Laboratorios Clínicos).
- Organismos Internacionales como FA, USP y otras farmacopeas, OMS, ICH (Conferencia Internacional Tripartita sobre Armonización).
- Organismos nacionales.

¿Cuándo Validar Métodos Analíticos?
Antes de decir, cuando se tiene validar los métodos analíticos hay que tener en cuenta cuales son los tipos de métodos analíticos que existen.
Existen tres tipos de método los cuales son los siguientes:
- Métodos Normalizados: Son métodos analíticos desarrollados por un organismo de normalización u otro organismo reconocido cuyos métodos son generalmente aceptados por el sector técnico correspondiente.
- Métodos No Normalizados: Son métodos analíticos desarrollado por un tercero o que ha sido adaptado por el laboratorio a partir de un método normalizado.
- Métodos de Laboratorio: Son métodos analíticos que no se encuentra en normas u otras colecciones de métodos, ni en publicaciones de terceros, habiendo sido desarrollado por el propio laboratorio.
Ya sabiendo cuales son los tipos de métodos analíticos se tiene que saber que los métodos que se validan son: los métodos no normalizados, los métodos diseñados por el laboratorio y los métodos normalizados que han sido modificados por el Laboratorio o utilizados fuera del alcance previsto, la validación de los métodos de ensayo debe:
- Reflejar las condiciones reales de ensayo.
- La extensión de la validación necesaria dependerá del método y su aplicación.
- La debe realizar personal calificado para esa actividad.
- En todos los casos un parámetro para la validación de ensayo es la descripción del método de ensayo
Nota: “El laboratorio debe confirmar que puede aplicar correctamente los métodos normalizados antes de las pruebas o calibraciones. Si el método normalizado cambia, la confirmación se repetirá “. USP
Existen algunas categorías en las cuales se dividen los métodos analíticos:
- Categoría I: Pruebas cuantitativas del contenido del principio activo, son procedimientos químicos o microbiológicos que miden al analito presente en una muestra determinada.
- Categoría II: Pruebas para la determinación del contenido de impurezas o de valores limites para el control de impurezas. Pueden ser de pruebas cuantitativas o una prueba cualitativa para determinar si la impureza esta presente en la muestra por encima o por debajo de un valor limite especificado.
- Categoría III: Son pruebas fisicoquímicas que miden características propias del desempeño del medicamento, por ejemplo, la prueba de disolución. Las características de la validación son diferentes a las de las otras pruebas, aunque las pueden incluir.
- Categoría IV: Pruebas de identificación. Aquellas que se realizan para asegurar la identidad de un analito en una muestra. Esteo se realiza por comparación de una propiedad de la muestra, contra la de un estándar de referencia, por ejemplo, espectros, comportamiento cromatográfico, reactividad química y pruebas microcristalinas.
- Métodos Microbiológicos: Son aquellos que se realizan para asegurar la calidad microbiana del analito.

Las categorías I Y II miden con exactitud las características de pureza de la muestra. Los parámetros de validación requeridos por una prueba cuantitativa son diferentes a los de una prueba cualitativa de cumplimiento de limite.
¿Cómo seleccionar e implementar un método analítico?
Para seleccionar un método analítico hay que tener en cuenta lo siguiente:
- De preferencia, que sea un método normalizado de versión reciente.
- Que el método sea apropiado para el tipo de muestra a analizar.
- Determinar si el laboratorio cuenta con el personal capacitado para el análisis a realizar.
- Determinar si el laboratorio cuanta con las instalaciones y condiciones ambientales requeridas para el análisis.
- Descripción del procedimiento incluyendo el alcance del método (aplicabilidad, tipo), tipo de compuestos y de matriz.
- Detalles de reactivos, estándares de referencia que se utiliza.
- Lista de equipos y requisitos de funcionamiento y rendimiento.
- Detalle de condiciones e implementación del método, incluyendo la preparación de la muestra.
- Definir los procedimientos estadísticos y cálculos representativos.
- Definir los procedimientos para e control de calidad en la rutina.
- Definir los gráficos representativos, cromatogramas, espectros y curvas de calibración.
- Definir los criterios de aceptación/rechazo de datos.
- Consideraciones de seguridad.
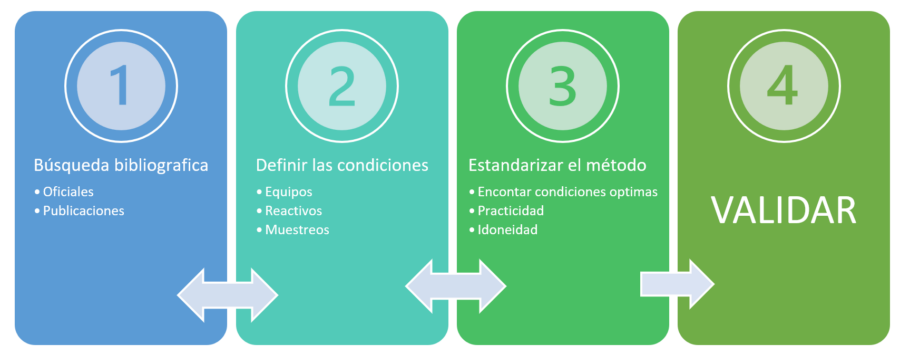
Se deben cubrir los siguientes requisitos de un método analítico antes de valida:
- Instrumentos calificados y/o calificados.
- Métodos documentados.
- Patrones de referencias confiables.
- Analistas calificados.
- Integridad de la muestra.
- Plan maestro de validación.

