-Leslie Cisneros
¿Ya tienes tu sistema computarizado validado? ¿Y ahora qué sigue?
¿Has escuchado hablar de la revisión periódica?
En esta entrada te vamos a explicar que es la revisión periódica, cuál es su finalidad la frecuencia con la que debes realizarla, hablaremos un poco del proceso a seguir y la documentación mínima necesaria para llevar a cabo una revisión periódica basada en riesgos.
¿Qué significa Revisión Periódica?
Una Revisión Periódica es una evaluación de varios elementos para determinar el estado de validación y las acciones necesarias para mantener el estado validado de nuestro sistema y para garantizar que sigue siendo apto para su uso previsto.
¿Qué entendemos por Mantenimiento del Estado Validado?
Son todas aquellas acciones enfocadas a documentar y analizar los cambios, errores o fallos que pueda tener un equipo, lo cual nos va a llevar a determinar si mantiene su estado validado. El mantenimiento del estado validado comprende la demostración continua, a través de la revisión de los datos del proceso, el control de los cambios, las desviaciones, las acciones correctivas, las acciones preventivas y otras actividades asociadas, de que el proceso de fabricación permanece bajo control y da lugar a un producto que garantiza la calidad y la seguridad del paciente.
¿Cuál es la finalidad de la Revisión Periódica?
La finalidad de una Revisión Periódica es confirmar que los sistemas se mantienen en un estado validado y cumplen con todas las normas y procedimientos aplicables a lo largo de su ciclo de vida operativo.
Frecuencia de la revisión periódica
Dependiendo del impacto GxP de tu sistema la frecuencia de la revisión periódica debe definirse. La frecuencia mínima recomendada es una vez al año después de que el sistema haya sido liberado para su uso productivo-
Elementos más comunes que debes considerar durante una revisión periódica:
– Informe de revisión periódica anterior, así como las acciones y recomendaciones realizadas
-Historial de cambios del sistema.
-Registros de mantenimiento, calibraciones y bitácora de uso del sistema.
-Documentación, la cual incluye procedimientos, registro de capacitaciones de los usuarios vigente, documentos de validacion y del ciclo de vida del sistema.
-Matriz de usuarios del sistema vigente, junto con la matriz de entrenamiento de los mismos.
-Registros de calidad, como desviaciones, CAPAS, auditorías, registros de cambios, etc.
-Registro de auditoría del sistema.
-Rendimiento del sistema
Proceso de Revisión Periódica
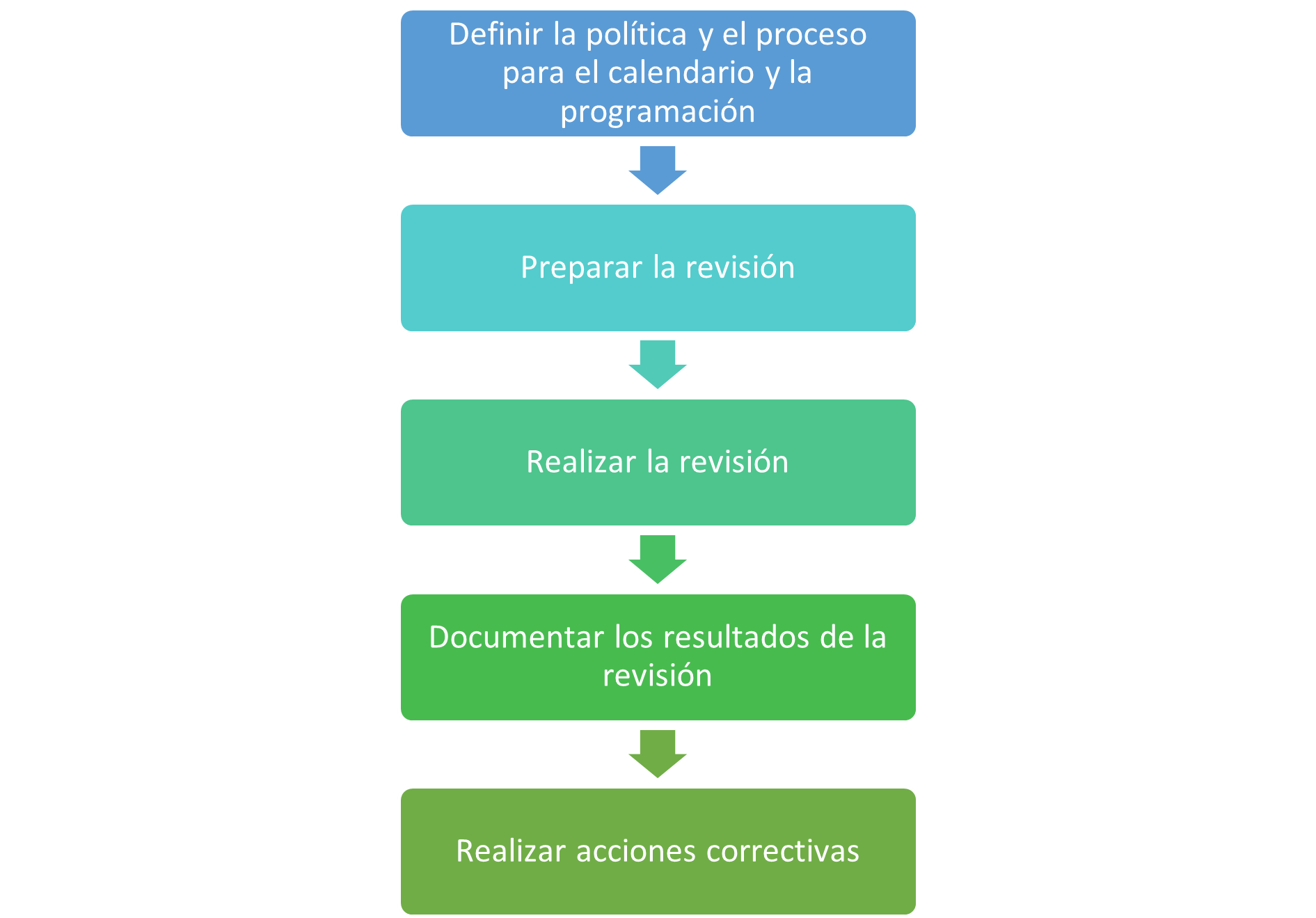
Generalmente la metodología que elijas llevar a cabo para las revisiones periódicas deberá estar plasmado en un procedimiento normalizado de operacion con las plantillas requeridas para llevar a cabo dicha revisión, y de acuerdo a la GAMP 5 el proceso a seguir seria el siguiente:
Tomado de la GAMP 5 “Un enfoque basado en el riesgo para el cumplimiento de los sistemas informáticos de GxP”, 2008.
¿Cuáles son mis responsabilidades?
Es responsabilidad del dueño del proceso garantizar que se realicen revisiones periódicas del sistema, tener en cuenta los resultados de la revisión y responder adecuadamente a ellos.
Es responsabilidad de la Unidad de Calidad garantizar que las revisiones periódicas se programen, se realicen y se documenten.
CONSIDERACIONES
- El proceso de revisión periódica debe ser genérico y aplicable a todos los sistemas. Debe aplicarse a los entornos operativos y no a los entornos de desarrollo o de prueba de apoyo
- La profundidad y el rigor de la revisión deben basarse en el impacto y la complejidad del sistema o en la naturaleza de un incidente o evento que desencadene una revisión.
- En algunos casos, la revisión periódica del sistema informático puede realizarse como parte de una actividad más amplia, como la revisión periódica de un proceso de fabricación.
- Las revisiones periódicas deben tener en cuenta y hacer referencia a otras revisiones apropiadas, como la revisión de los registros de seguridad, y no duplicar actividades.
- Puede ser útil elaborar listas de comprobación de revisiones periódicas específicas para sistemas concretos.
- Debe definirse un proceso para el calendario y la programación de las revisiones. Los períodos de revisión para sistemas específicos deben basarse en el impacto y la complejidad del sistema.
- Sea cual sea la metodología que se elija, el proceso debe estar documentado y aprobado por la dirección de la empresa regulada, y la responsabilidad y los criterios de decisión deben estar claramente definidos.
- También debe definirse claramente la responsabilidad de gestionar el proceso de planificación y programación, y de asignar recursos a las revisiones.
¿Necesitas ayuda para elaborar tu procedimiento y plantillas para la revisión periódica de tus sistemas? ¿O prefieres que algún tercero te apoye con las revisiones periódicas de todos tus sistemas GxP? Nosotros tenemos la experiencia para realzar estas revisiones. Nosotros te podemos apoyar. No dudes en contactarnos.