Asuntos regulatorios de la industria farmacéutica y biotecnológica
En el sector farmacéutico y biotecnológico, la garantía de calidad y los asuntos regulatorios son difíciles de disociar. Por eso QbD le ofrece el paquete completo.
No sólo nos ocupamos de la gestión de la calidad, sino que también le apoyamos a lo largo de todo el ciclo de vida regulatorio de los medicamentos o productos sanitarios.
Tanto si se trata de productos farmacéuticos tradicionales como de genéricos, cosméticos, vacunas, productos biológicos, biosimilares, productos sanitarios o medicamentos de terapia avanzada (ATMP).

Resumen de conocimientos de nuestros servicios de AR

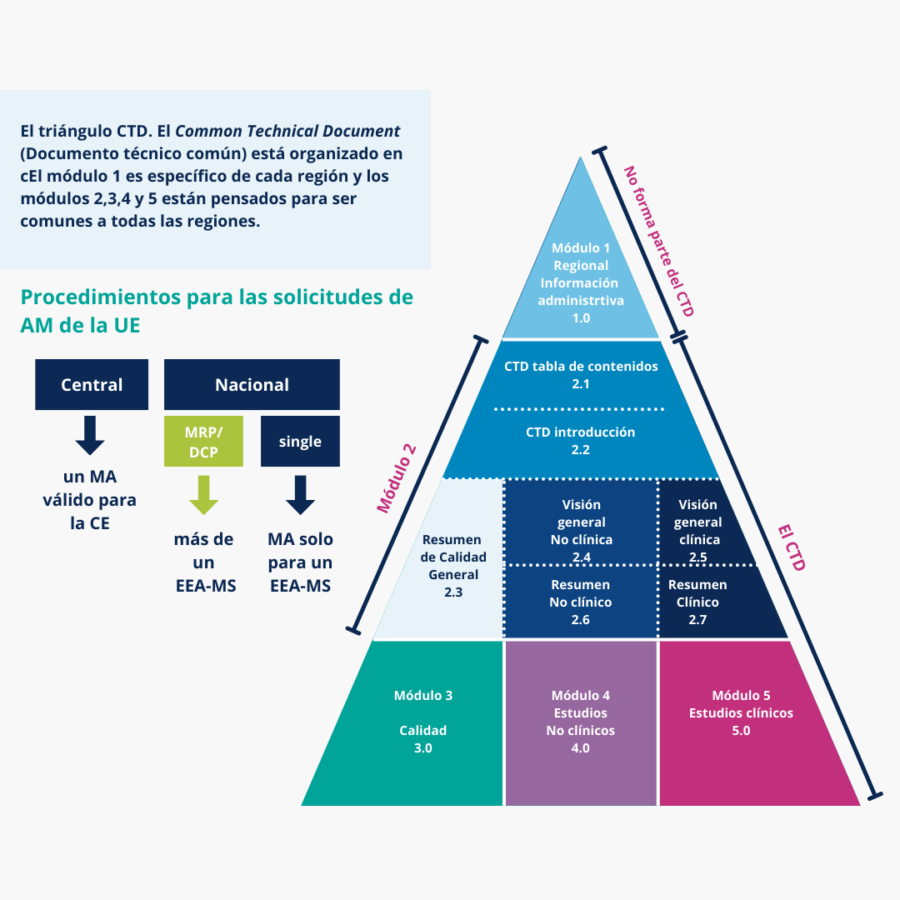
Estrategia normativa
- Aplicaciones de estudios clínicos (CTA, IB, IMPD, etc.)
- Procedimiento acelerado (PIP, ODD, etc.)
- Presentaciones reglamentarias (MAA, eCTD, NeeS, etc.)
- Líder de gestión de programas y proyectos (PML)
- Estrategia de presentación/registro
- Interpretación de la legislación
- Análisis de las deficiencias del expediente y diligencia debida
- Cálculo de las tasas de las autoridades
- Asesoramiento científico
Redacción normativa y científica
- Redacción de archivos de presentación (eCTD)
- Análisis de carencias y actualización del CMC
- Política 0070: guía de aplicación
- Introduzca los datos en EudraCT (Europa) y clinicaltrials.gov (FDA)
- Experiencia en medicamentos innovadores, biológicos y biosimilares
- Redacción de expedientes: generación de módulos de informes periciales 2.3 - 2.4 - 2.5 - 2.6
- Redacción del CMC del módulo 3
- Informe de evaluación ambiental (ERA) (Módulo 1.6)
- EU-RMP (Módulo 1.8.2)
- Escritura técnica: transferencia de datos brutos a informes conformes con la normativa
Envíos globales
- Europa: Procedimiento centralizado y procedimiento descentralizado
- Proyectos de la FDA (IND, eNDA, eBLA, ANDA)
- Experiencia en mercados emergentes
- EDQM: presentación del expediente CEP
- Traducciones
- Pruebas de legibilidad
Asuntos reglamentarios postcomercialización para la industria farmacéutica y biotecnológica
- Seguridad posterior a la aprobación
- Renovaciones y variaciones
- Reenvío de MA
- Revisión anual de productos
- Artículo 57 mantenimiento de la base de datos
LIBRO BLANCO
Asuntos regulatorios para farmacia y biotecnología
En este libro blanco gratuito, aprenderá más sobre los servicios de regulación que QbD Group ofrece a las industrias farmacéutica y biotecnológica.
¿Por qué el Grupo QbD?
Para transformar los datos de desarrollo, formulación y fabricación de sustancias activas y/o formas farmacéuticas acabadas en un expediente conforme que pueda presentarse a las autoridades reguladoras para su revisión y aprobación, se necesita un grupo de redactores expertos en CMC. QbD puede ayudarle a redactar el módulo de calidad adecuado en CTD en función de la fase en la que se encuentre su medicamento, ya sea en una fase clínica o en la fase de solicitud de autorización de comercialización. Nuestros expertos pueden realizar las revisiones bibliográficas necesarias y preparar los informes periciales pertinentes.
Le apoyamos en la presentación de solicitudes de autorización de comercialización de medicamentos con principios activos nuevos o conocidos, con o sin innovación (genéricos). En el caso de los medicamentos innovadores, en particular, los procedimientos de aprobación pueden ser complejos y largos. En este caso, nuestro equipo de asuntos regulatorios puede tomar la iniciativa en la preparación de las reuniones con las autoridades (asesoramiento científico, presentación previa, aclaración, solicitud de un ATMP o de una clasificación huérfana).
Nuestros responsables de asuntos normativos le ayudarán:
- desarrollar la estrategia de presentación adecuada (UE: CP, NP, MRP o DCP)
- elaborar un expediente eCTD conforme
- presentar la solicitud de autorización de comercialización en los países requeridos, según el procedimiento de registro predefinido, incluyendo la preparación de las respuestas a las preguntas oficiales y el seguimiento hasta el final del procedimiento
Una vez aprobadas las autorizaciones de comercialización, deben mantenerse y actualizarse continuamente para garantizar que el proceso de fabricación aprobado en el expediente coincide con la realidad en el o los centros de fabricación.
Nuestro equipo de AR puede ayudarle a introducir sus medicamentos en el mercado y a mantener las autorizaciones de comercialización durante todo el ciclo de vida. Las actividades posteriores a la aprobación (como renovaciones, variaciones, revisiones anuales del producto, base de datos del artículo 57, transferencias, etc.) pueden ser gestionadas por nuestro equipo de asuntos regulatorios.
Una solución completa de Asuntos Regulatorios
Nuestros consultores ofrecen amplios conocimientos y experiencia en materia de asuntos reglamentarios para la industria farmacéutica y biotecnológica. Tenemos los conocimientos y la experiencia para apoyar a su equipo o para subcontratar proyectos completos de asuntos regulatorios, todo ello de forma eficiente y pragmática.
Nuestros servicios de Asuntos Regulatorios para la industria farmacéutica y biotecnológica incluyen la redacción y estructuración de los expedientes de registro de acuerdo con la legislación de varios países y la integración de todos los datos (técnicos) necesarios.
Contacto con nosotros
Póngase en contacto con nosotros para obtener más información o solicitar una propuesta gratuita y sin compromiso.