Computer Software Assurance (CSA) (Garantía de sistemas informáticos en español) es un término relativamente nuevo en la industria farmacéutica y de ciencias de la vida. La Food and Drug Administration (FDA) emitió en septiembre del 2022 el borrador de la directriz “Computer Software Assurance for Production and Quality System Software” cuya finalidad es representar el pensamiento actual de la FDA sobre esta cuestión. Se trata de un enfoque que busca mejorar el tiempo, los recursos y los costes, pero sobre todo se centra en el impacto del software en la seguridad del paciente, el impacto en la calidad del producto y el impacto en la integridad del sistema de calidad, en comparación con la validación tradicional, más conocida como validación de sistemas computarizados (VSC). Actualmente la guía sigue en borrador y espera por ser publicada en su versión final.
El concepto de CSA tiene su origen en la petición de la industria estadounidense de dispositivos médicos que deseaba mayor claridad en cuanto a las expectativas de la FDA en materia de validación y su propósito es describir un enfoque basado en riesgo para establecer la confianza en la automatización utilizada para los sistemas de producción o calidad e identificar dónde puede ser apropiado un rigor adicional, así como describir varios métodos y actividades de prueba que pueden aplicarse para establecer la garantía del software informático y proporcionar pruebas objetivas para cumplir con los requisitos reglamentarios, tales como los requisitos de validación de software informático en CFR 21 parte 820 que cita los requisitos de nuevas prácticas de manufactura que deben cumplir las compañías dedicadas al diseño, manufactura, empaque, etiquetado, almacenamiento, instalación y servicios de dispositivos médicos de uso humano.
La FDA considera que estas recomendaciones contribuirán a fomentar la adopción y el uso de tecnologías innovadoras que promuevan el acceso de los pacientes a productos de alta calidad y ayuden a los fabricantes a seguir el ritmo de un panorama tecnológico dinámico y en rápida evolución, promoviendo al mismo tiempo el cumplimiento de las leyes y reglamentos aplicados en el sector de los productos sanitarios.
En este blog describiremos qué es el CSA, sus principios y cuáles son sus objetivos.
Garantía de los programas informáticos
El aseguramiento del software informático es un enfoque basado en el riesgo para establecer y mantener la confianza en que el software es adecuado para su uso previsto. Dado que el esfuerzo de aseguramiento del software informático se basa en el riesgo, la carga de validación no es mayor de lo necesario para abordar el riesgo.
Tradicionalmente, la validación del software se ha llevado a cabo mediante pruebas y otras actividades de verificación realizadas en cada fase del ciclo de vida, sin embargo, las pruebas por sí solas suelen ser insuficientes para establecer la confianza de que el software es adecuado para su uso previsto. En su lugar, la garantía de calidad del software sugiere centrarse en prevenir la introducción de defectos desde la etapa de desarrollo del software utilizando un enfoque basado en el riesgo para establecer la confianza de que el software es adecuado para su uso previsto.
Este enfoque mejora el uso eficiente de los recursos, promoviendo a su vez la calidad del producto.
Pero… ¿en qué consiste el CSA?
Se trata de destacar en el pensamiento crítico en el proceso de validación para aplicar el nivel adecuado de pruebas a las actividades de mayor riesgo, con una disminución considerable del tiempo dedicado a la documentación, reduciendo así el esfuerzo de validación y centrando los esfuerzos en mejorar la calidad y el grado de cumplimiento.
El enfoque CSA no reduce las pruebas, sino que promueve más pruebas con menos documentación. Es más importante eliminar errores y mejorar los procesos que recopilar documentación con fines de inspección o revisión. CSA promueve que los esfuerzos realizados tengan como objetivo aportar valor añadido siempre que la documentación disponible sea suficiente para confirmar los requisitos de seguridad del paciente, calidad del producto e integridad de los datos. CSA también lleva a realizar menos pruebas funcionales estándar y a prestar más atención a las pruebas de aceptación del usuario (UAT), en las que los usuarios ponen a prueba sus procesos de negocio y el uso previsto del sistema.
En palabras simples, el principal objetivo del CSA es reducir el esfuerzo y, como consecuencia, reducir el tiempo, que a su vez reducirá el coste en comparación con la validación de sistemas computarizados (VSC) tradicional.
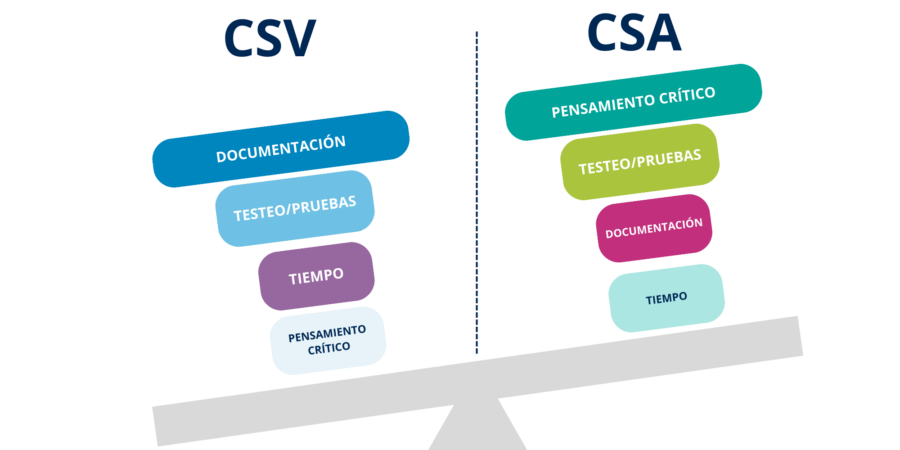
¿En qué se diferencian las pruebas VSC tradicionales de las pruebas CSA?
CSA introduce los términos “Scripted Testing” y “Unscripted Testing” .
Las pruebas ” Scripted Testing ” tradicionales son las que suelen contener, como mínimo, un objetivo de prueba para el protocolo, un procedimiento de prueba paso a paso, los resultados esperados y un dictamen Pasa/Falla o cumple/no cumple. Las pruebas paso a paso se utilizan para probar sistemas o funciones de alto riesgo, ya que el software afecta directamente a la seguridad del producto o del paciente.
Las ” Unscripted Testing ” se realizan sin utilizar descripciones de prueba detallados. Las pruebas no detalladas se utilizan para probar sistemas o funciones de menor riesgo, ya que el software no afecta directamente al producto o a la seguridad del paciente, pero sí al sistema de calidad. Puede tener un objetivo de prueba y un Pasa/Falla o cumple/no cumple y omitir un procedimiento de prueba paso a paso.
¿Cuál es el papel del proveedor del sistema?
El proveedor del sistema desempeña un papel importante en el nuevo enfoque CSA, ya que sugiere que debemos aprovechar sus conocimientos y recursos, así como asegurarnos de verificar que haya sido previamente auditado. Los proveedores de sistemas en nube también deben mantener el estado validado del sistema en caso de nuevas actualizaciones mediante un sistema de gestión de la calidad adecuado que garantice la validación continua del software y su infraestructura. De este modo, podremos aprovechar el esfuerzo de validación del proveedor para reducir recursos y costes, al tiempo que obtenemos una mayor eficiencia y calidad.
¿Cuáles son las ventajas de implantar la CSA?
- Reducción del tiempo necesario para crear, revisar y aprobar documentos de pruebas (protocolos y guiones).
- Aprovechar toda la información posible del proveedor para reducir el esfuerzo de las pruebas.
- Un sistema puede dividirse en funcionalidades, y sólo las funcionalidades de alto riesgo requerirán pruebas con secuencias de comandos, es decir, pruebas más detalladas y descritas paso a paso.
- Pruebas centradas en garantizar la calidad del software.
- Reducción del tiempo de ejecución de los scripts de prueba.
- Reducción del número de documentos generados.
Si necesita apoyo en la aplicación del nuevo enfoque CSA, o formación, no dude en ponerse en contacto con nosotros.
Guía completa para la validación de sistemas informáticos
Esta guía de más de 100 páginas pretende contextualizar y definir las estrategias necesarias y adecuadas para la validación de sistemas informatizados para Industrias Farmacéuticas, Biológicas, Biotecnológicas, Hemoderivados, Medicamentos y Productos Sanitarios, utilizados en actividades relacionadas con el cumplimiento de las Buenas Prácticas (GxP). Descárguelo ahora gratuitamente:


