La terapia celular CAR-T, un avance pionero en la industria farmacéutica durante los últimos 20 años, ejemplifica los avances innovadores realizados en áreas como las proteínas recombinantes, las tecnologías de ARNm y las terapias celulares avanzadas. Este progreso se vio respaldado por el Reglamento europeo 1394/2007, que estableció el marco regulador de los medicamentos de terapia avanzada (MTA) en Europa, clasificándolos en 4 clases de productos:
- Medicamentos de terapia celular somática (sCTMP)
- Medicamentos de terapia génica (GTMP)
- Productos de ingeniería tisular (TEP)
- ATMP combinados
Entre ellos destaca la terapia con células T receptoras de antígenos quiméricos (CAR). Las células CAR-T se clasifican en la categoría de medicamentos de terapia génica, ya que se basan en células T modificadas genéticamente. La modificación consiste en integrar un transgén en el genoma de la célula T, que codifica el CAR. Esta alteración genética produce células CAR-T, que desempeñan un papel crucial en la acción inmunológica de la terapia.
La andadura de las terapias con células CAR-T comenzó a finales de los años ochenta. A pesar de la existencia de una importante cartera de productos y de los numerosos ensayos clínicos en curso, sólo dos terapias CAR-T autólogas anti-CD19 han recibido autorización de comercialización en Europa y Estados Unidos hasta la fecha:
- Kymriah®, tisangenlecleucel (Novartis Europharm), aprobado para el tratamiento de pacientes pediátricos y jóvenes de hasta 25 años de edad con leucemia linfoblástica aguda (LLA) de células B refractaria, en recaída postrasplante o en segunda recaída o posterior, y para pacientes adultos con linfoma difuso de células B grandes (DLBCL) en recaída o refractario tras dos o más líneas de tratamiento sistémico.
- Yescarta®, axicabtagene ciloleucel (Kite Pharma), aprobado para pacientes adultos con linfoma difuso de células B grandes (LDCBG) en recaída o resistente al tratamiento y linfoma mediastínico primario de células B grandes (LMPBG), tras dos o más líneas de tratamiento sistémico.
En la actualidad, estas terapias se dirigen principalmente a los cánceres hematológicos (de la sangre). En esta entrada del blog, profundizaremos en los elementos clave de la terapia celular CAR-T, incluidas la célula T y la CAR, exploraremos su marco normativo y sus procesos de fabricación, y analizaremos las perspectivas de futuro de esta terapia con células inmunitarias efectoras (IEC).
Terapia celular CAR-T: aprovechar el poder de las células T
Los orígenes de las células B y T
Las células T, también llamadas linfocitos T, son uno de los componentes más importantes del sistema inmunitario adaptativo, además de las células B.
Todos los elementos celulares de la sangre, como los glóbulos rojos, las plaquetas y los glóbulos blancos, se originan a partir de las mismas células precursoras (también llamadas células progenitoras), a saber, las células madre hematopoyéticas de la médula ósea. Estas células madre multipotentes pueden diferenciarse en células progenitoras mieloides y células progenitoras linfoides.
De estas células progenitoras mieloides derivan los monocitos (macrófagos en forma madura), las células dendríticas, los granulocitos y los mastocitos . Estas células no se tratarán con más detalle en esta entrada del blog. El segundo grupo de células progenitoras - las células progenitoras linfoides - dan lugar a los linfocitos y a las células asesinas naturales (células NK).
Existen dos tipos principales de linfocitos: Los linfocitos B (células B) y los linfocitos T (células T). Los linfocitos B maduran en la médula ósea, mientras que los linfocitos T migran al timo para madurar. Una vez maduros, los linfocitos T y B entran en el torrente sanguíneo y migran a los órganos linfoides periféricos (por ejemplo, los tejidos linfoides asociados a las mucosas, como el apéndice, los ganglios linfáticos y el bazo) para llevar a cabo sus tareas de respuesta inmunitaria adaptativa.
Estos diferentes linfocitos no pueden distinguirse en función de aspectos morfológicos, pero pueden clasificarse en función de sus receptores únicos, células T y células B, o de la ausencia de un receptor específico en el caso de las células NK.
3 tipos específicos de células T: materiales de partida para la terapia celular CAR-T
Los tipos específicos de células T obtenidos por leucaféresis (que se describirán más adelante) servirán como materiales de partida en el proceso de fabricación de CAR-T, como se explicará más adelante. Se pueden distinguir tres subconjuntos principales de células T, a saber:
Células T efectoras (Teff)
- Las células Th ayudarán a la respuesta inmunitaria mediante la liberación de citocinas.
- Las células TC, por otro lado, están involucradas en la destrucción de las células infectadas viralmente y las células tumorales.
Células T regulatorias (Treg)
Los linfocitos T reguladores son CD4+ y CD25+ desempeñan un papel crucial en el cese de la inmunidad mediada por linfocitos T y, por lo tanto, estas células son capaces de controlar y suprimir la respuesta inmunitaria.
Células T de memoria (Tm)
Células T específicas de antígeno que permanecen en el cuerpo después de la infección (memoria inmunológica).
De células T vírgenes a células T efectoras
Tras la maduración completa, la célula T vírgenes (célula T inactivada) buscará antígenos extraños.
El receptor de antígenos de células T (TCR) presente en la membrana de la célula T reconoce péptidos derivados de proteínas o patógenos extraños, por ejemplo, células tumorales o células infectadas por virus, asociados a una molécula del Complejo Mayor de Histocompatibilidad (MHC).
Otros cuatro dominios de señalización -denominados colectivamente CD3- y las cadenas ζ, son necesarios para que la célula T sepa que el péptido está unido.
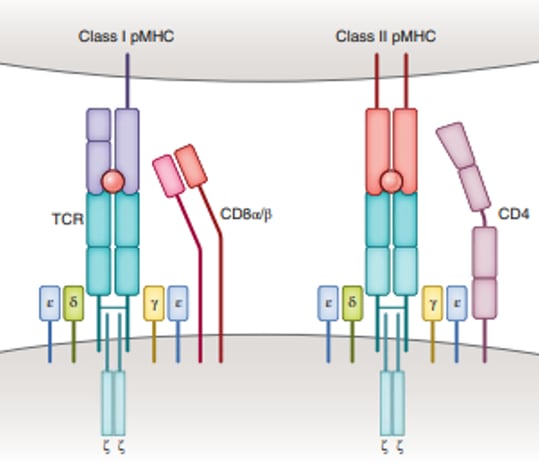
Figura 1- Base molecular del reconocimiento del CMH por el TCR y el péptido. El complejo TCR contiene las cadenas CD3ζ, CD3γ, CD3δ y CD3ε (fuente: referencia 3).
Dependiendo de la clase del CMH (I o II), se unirá un tipo diferente de célula T virgen. Las células Tc (CD8+) reconocerán antígenos en asociación con moléculas MHC de clase I y las células Th están implicadas para moléculas MHC de clase II (Figura 1).
Para la proliferación y diferenciación de las células T ingenuas en células T efectoras (células T activadas), se debe recibir una señal coestimuladora no específica de la célula presentadora de antígeno (APC) además de la unión específica del TCR. De hecho, CD28 de la célula T se une a CD80/CD86 en la APC (Figura 2).
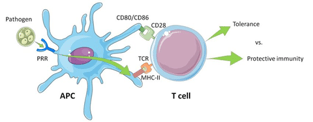
Figura 2- Ilustración de la activación de una célula T mediante la interacción entre las moléculas MHC de clase II de la célula presentadora de antígeno y el receptor de células T (TCR) y la señal coestimuladora del CD28 con CD80/CD86. (Fuente referencia 4)
Aunque las células T son muy eficaces, algunos patógenos o células malignas han encontrado formas de escapar a este reconocimiento de antígenos y, por lo tanto, pueden eludir el sistema de vigilancia de células T del sistema inmunitario. Se han inventado nuevas tecnologías para superar esta barrera, concretamente la reingeniería de la célula T en una célula CAR-T para terapias con células CAR-T.
CAR: reconocimiento de antígenos por ingeniería genética
¿Qué son las CAR?
CAR son las siglas de Chimeric Antigen Receptor (receptor quimérico de antígenos), ya que está compuesto por varios dominios derivados de distintos componentes mediante una manipulación ex vivo de ingeniería, como los anticuerpos quiméricos (Ab) derivados de distintas especies (por ejemplo, una combinación de anticuerpos humanos y de ratón).
En el caso de los CAR, el dominio de reconocimiento de antígeno se deriva de un Ab y el dominio de señalización de células T CD3ζ se deriva del TCR.
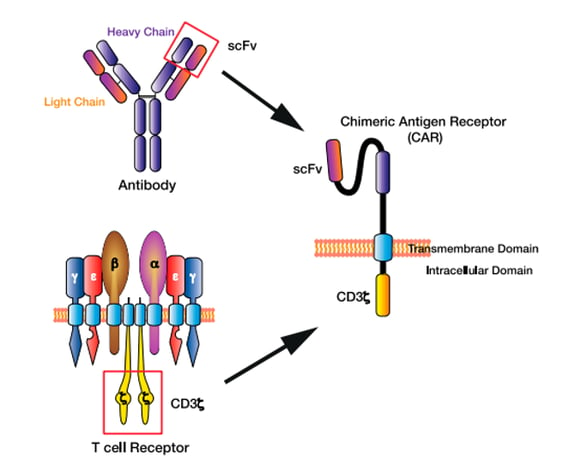
Figura 3 - Diseño de la célula T con receptor de antígeno quimérico (CAR). El fragmento variable de cadena única (scFv) del CAR deriva de las cadenas pesada y ligera de la región variable del anticuerpo, mientras que el dominio CD3ζ del CAR deriva de los dominios de señalización intracelular del receptor de células T. (fuente referencia 5)
4 ámbitos principales de CAR
Desde el desarrollo del primer CAR, se han creado varias generaciones nuevas para aumentar la persistencia, la actividad y la regulación de las células CAR-T. En general, los CAR constan de 4 dominios principales con sus acciones específicas:
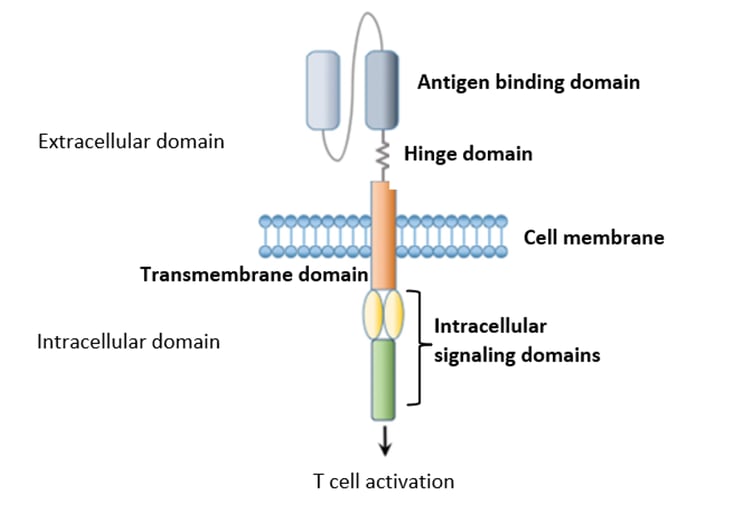
Figura 4 - Estructura de los CAR (fuente: referencia 7)
Dominio de unión al antígeno
Unión específica de las células T al antígeno diana de forma independiente del MHC.
Dominio de bisagra
Facilita el acceso al Ag.
Dominio transmembrana
Anclaje del CAR en la membrana celular (influye en la estabilidad y función del CAR).
Los dominios de señalización intracelular
Por lo general, contiene el dominio de activación (CD3ζ) y uno (o más) dominios coestimuladores (CD28, 4-1BB, ....). Las diferentes generaciones de CAR se definen en función del diseño de sus dominios de señalización6.
Terapia celular CAR-T: proceso de fabricación desde el donante (muestra de sangre) hasta la administración (infusión)
En la actualidad, sólo se ha autorizado la comercialización de dos CAR-T autólogas. Por lo tanto, se destacarán los aspectos clave del proceso de fabricación de una terapia autóloga.
La industria está desarrollando procesos de fabricación automatizados cerrados o semicerrados (por ejemplo, Miltenyi CliniMACS Prodigy) para reducir el riesgo de contaminación del producto y acelerar el tiempo de administración de la vena a la vena, es decir, reducir todo el tiempo de fabricación desde el punto de donación hasta la administración.
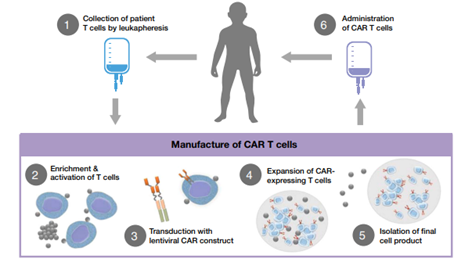
Figura 5 - Diagrama del proceso de tratamiento con células T CAR (fuente: referencia 8)
Retos de la terapia celular CAR-T
En esta entrada del blog se analizarán cuatro retos principales. Para más información, consulte a los expertos en ATMP de QbD.
Paso 1: Leucoféresis
La donación, la obtención y las pruebas de células para ATMP deben realizarse de acuerdo con la Directiva 2004/23/CE9 sobre tejidos humanos (Reg1394/2007 (14)).
Los donantes (pacientes) se someterán a una leucoféresis. La leucoféresis es una técnica específica de separación en la que se recogen los componentes celulares de la sangre y más concretamente los leucocitos (glóbulos blancos). Estas células mononucleares de sangre periférica (PBMC) contienen los diferentes linfocitos (células T/células B/células NK) y monocitos (macrófagos, células dendríticas). Los contaminantes, como los glóbulos rojos y las plaquetas, pueden eliminarse mediante el lavado10. El lavado y enriquecimiento mononuclear (linfocitos y monocitos) se realiza mediante el uso de dispositivos como el lavador de células Lovo (Fresenius Kabi), el Terumo COBE 2991 (Terumo BCT) y el dispositivo Sepax (Sepax Technologies Inc.)10.
La condición médica del donante autólogo afectará el rendimiento y la pureza del producto CAR-T. Por lo tanto, se deben establecer criterios de elegibilidad de los donantes antes de iniciar la terapia CAR-T y se deben aplicar los procedimientos y normas aplicables para limitar la variabilidad del material.
Paso 2: Enriquecimiento y activación de células T
La figura 5 incluye un recuadro morado que muestra los pasos 2 a 5, ya que estos pasos deben cumplir con los requisitos establecidos en EudraLex Volumen 4 Parte IV – Requisitos de GMP para medicamentos de terapia avanzada11.
Después de la leucoféresis y el lavado, los subconjuntos de linfocitos T (CD4, CD8, CD25, etc.) se enriquecen mediante el uso de la separación inmunomagnética en los dispositivos Miltenyi CliniMAC y Prodigy)10. Este paso se realiza seleccionando células CD4+, CD8+, CD25+ utilizando perlas magnéticas recubiertas con anticuerpos anti-CD4, anti-CD8 y anti-CD25. Estas células T procesadas pueden utilizarse directamente en procesos posteriores o criopreservarse para su uso posterior.
En el siguiente paso del proceso, se activan las células T, a lo que sigue la proliferación de las células T mediante la adición de citocinas específicas. La activación de los linfocitos T se obtiene simulando la unión simultánea in vivo del receptor de linfocitos T CD3 y el correceptor CD28 a su ligando, a saber, CD80/86 y MHC, que están representados in vitro por dos anticuerpos anti-CD3 y anti-CD28 unidos adherido a una perla inmunomagnética (Dynal Dynabeads: Human TActivator) o perlas Miltenyi (TransAct)10.
Other activation methods are also reported, for example, the use of Expamer (trademarked by Juno Therapeutics). Here, a soluble StrepTactin protein oligomer forms the backbone for the anti-CD3 and anti-CD28 ligands10.
Paso 3 – 4: Transducción y expansión
En la actualidad, los dispositivos más utilizados son el G-Rex (Wilson Wolf Manufacturing), el Biorreactor Wave (GE Life Systems) y el CliniMACS Prodigy (Miltenyi Biotec)10. Para la transducción de los linfocitos T se utilizan principalmente vectores γ-retrovirales y vectores lentivirales que se añaden al vaso específico en el que se encuentran los linfocitos T. También se están investigando otros métodos no virales, como el sistema transposón/transposasa o la transferencia de ARNm por electroporación10.
Dado que estas células T se someten a modificaciones genéticas, los productos de células CAR-T también deben cumplir con los requisitos de organismos genéticamente modificados (OGM). Esto puede ser un gran desafío, ya que las directivas de la UE sobre OGM se implementan e interpretan de manera diferente en los diferentes Estados miembros de la UE. Los obstáculos regulatorios deben superarse de manera oportuna para obtener la aprobación para la ejecución de ensayos clínicos y, en última instancia, la autorización de comercialización. Consulta con nuestro departamento de regulación si tienes alguna pregunta.
Después de una transducción exitosa, las células CAR-T se expanden. El objetivo de este último paso es aumentar el número de células transducidas que expresan CAR y, en última instancia, obtener la cantidad deseada de células. Por ejemplo, los pacientes adultos jóvenes (50 kg o menos) con LLA de células B que reciben Kymriah necesitarán la siguiente dosis: 0,2 a 5 x 106 células T viables CAR-positivas/kg de peso corporal. El medicamento en sí contendrá 1 o más bolsas de perfusión, cada una de las cuales contendrá de 1,2 x 106 a 6 x 108 células T viables CAR-positivas. Dado que se necesitan millones de células, el rendimiento es un factor muy importante a tener en cuenta para estos tratamientos autólogos.
Paso 5: Aislamiento del producto final
Después de la expansión, las células recolectadas se lavan y centrifugan. Se añaden crioprotectores para la criopreservación del fármaco. El método más utilizado es la resuspensión en un medio de almacenamiento que contenga un 10% de dimetilsulfóxido, seguido del almacenamiento en nitrógeno líquido en la fase de vapor 10.
Paso 6: Administración
Antes de que el producto pueda administrarse al paciente a través de una perfusión, el paciente debe someterse a una terapia de acondicionamiento, es decir, a la linfodepleción por quimioterapia.
Perspectivas y retos futuros de la terapia celular CAR-T
Las terapias con células CAR-T han demostrado su enorme potencial en el tratamiento de las neoplasias malignas de células B CD19. No obstante, su actividad antitumoral y su perfil de seguridad pueden mejorarse en otras neoplasias malignas (como los tumores sólidos). Se seguirán estudiando nuevas estrategias para reducir los costes y la posibilidad de pasar a productos alogénicos disponibles en el mercado.
Algunos de los obstáculos que habrá que superar en un futuro próximo son el escape de antígenos, la falta de persistencia in vivo, los problemas de penetración tumoral, el microentorno inmunosupresor, la toxicidad sistemática de las citocinas, los efectos no tumorales en el objetivo y la linfopenia, el tiempo de producción o los CAR-T fuera de especificaciones (OOS).
- Reglamento (CE) nº 1394/2007 del Parlamento Europeo y del Consejo, de 13 de noviembre de 2007, sobre medicamentos de terapia avanzada y por el que se modifican la Directiva 2001/83/CE y el Reglamento (CE) nº 726/2004 (Texto pertinente a efectos del EEE) DO L 324 de 10.12.2007, p. 121-137, CELEX: https://eur-lex.europa.eu/legal-content/EN/TXT/HTML/?uri=CELEX:32007R1394)
- Kuwana, Y., Asakura, Y., Utsunomiya, N., Nakanishi, M., Arata, Y., Itoh, S., Nagase, F., & Kurosawa, Y. (1987). Expression of chimeric receptor composed of immunoglobulin-derived V regions and T-cell receptor-derived C regions.Biochemical and Biophysical Research Communications, 149(3), 960-968.
- Joglekar, A. V., & Li, G. (2021). T cell antigen discovery.Nature Methods, 18(8), 873-880.
- Srivastava, A. D., Unione, L., Bunyatov, M., Gagarinov, I. A., Delgado, S., Abrescia, N., Ardá, A., & Boons, G. J. (2021). Chemoenzymatic Synthesis of Complex N-Glycans of the Parasite S. mansoni to Examine the Importance of Epitope Presentation on DC-SIGN recognition.Angewandte Chemie (ed. internacional en inglés), 60(35), 19287-19296.
- Hughes-Parry, H. E., Cross, R. S., & Jenkins, M. R. (2019). La ingeniería de proteínas en evolución en el diseño de células T receptoras de antígenos quiméricos. Revista internacional de ciencias moleculares, 21(1), 204.
- Singh, A. K., & McGuirk, J. P. (2020). Células T CAR: continuación en una revolución de la inmunoterapia. The Lancet. Oncology, 21(3), e168-e178
- Han, S., Latchoumanin, O., Wu, G., Zhou, G., Hebbard, L., George, J., & Qiao, L. (2017). Ensayos clínicos recientes que utilizan terapias con células T receptoras de antígenos quiméricos contra tumores sólidos.Cancer letters,390, 188-200.
- Hucks, G., Rheingold, S.R. The journey to CAR T cell therapy: the pediatric and young adult experience with relapsed or refractory B-ALL. Blood Cancer Journal 9, 10 (2019).
- Directiva 2004/23/CE del Parlamento Europeo y del Consejo, de 31 de marzo de 2004, relativa al establecimiento de normas de calidad y de seguridad para la donación, la obtención, la evaluación, el procesamiento, la preservación, el almacenamiento y la distribución de células y tejidos humanos (DO L 102 de 31.03.2004, p. 48, CELEX: https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=CELEX:32004L0023).
- Gee A. P. (2018). Producción de células CAR-T GMP. Buenas prácticas e investigación. Hematología clínica, 31(2), 126-134.
- Parte IV de las Directrices de prácticas correctas de fabricación para medicamentos de terapia avanzada (2017), publicadas en el volumen 4 de Eudralex.
- Rafiq, S., Hackett, C. S., & Brentjens, R. J. (2020). Estrategias de ingeniería para superar los bloqueos actuales en la terapia con células T CAR. Nature reviews. Clinical oncology, 17(3), 147-167.
- Reglamento (CE) nº 1394/2007 del Parlamento Europeo y del Consejo, de 13 de noviembre de 2007, sobre medicamentos de terapia avanzada y por el que se modifican la Directiva 2001/83/CE y el Reglamento (CE) nº 726/2004 (Texto pertinente a efectos del EEE) DO L 324 de 10.12.2007, p. 121-137, CELEX: https://eur-lex.europa.eu/legal-content/EN/TXT/HTML/?uri=CELEX:32007R1394).
- Kuwana, Y., Asakura, Y., Utsunomiya, N., Nakanishi, M., Arata, Y., Itoh, S., Nagase, F., & Kurosawa, Y. (1987). Expression of chimeric receptor composed of immunoglobulin-derived V regions and T-cell receptor-derived C regions. Biochemical and Biophysical Research Communications, 149(3), 960-968.
- Joglekar, A. V., & Li, G. (2021). T cell antigen discovery. Nature Methods, 18(8), 873-880.
- Srivastava, A. D., Unione, L., Bunyatov, M., Gagarinov, I. A., Delgado, S., Abrescia, N., Ardá, A., & Boons, G. J. (2021). Chemoenzymatic Synthesis of Complex N-Glycans of the Parasite S. mansoni to Examine the Importance of Epitope Presentation on DC-SIGN recognition. Angewandte Chemie (ed. internacional en inglés), 60(35), 19287-19296.
- Hughes-Parry, H. E., Cross, R. S., & Jenkins, M. R. (2019). La ingeniería de proteínas en evolución en el diseño de células T receptoras de antígenos quiméricos. Revista internacional de ciencias moleculares, 21(1), 204.
- Singh, A. K., & McGuirk, J. P. (2020). Células T CAR: continuación en una revolución de la inmunoterapia. The Lancet. Oncology, 21(3), e168-e178
- Han, S., Latchoumanin, O., Wu, G., Zhou, G., Hebbard, L., George, J., & Qiao, L. (2017). Ensayos clínicos recientes que utilizan terapias con células T receptoras de antígenos quiméricos contra tumores sólidos.Cancer letters,390, 188-200.
- Hucks, G., Rheingold, S.R. The journey to CAR T cell therapy: the pediatric and young adult experience with relapsed or refractory B-ALL. Blood Cancer Journal 9, 10 (2019).
- Directiva 2004/23/CE del Parlamento Europeo y del Consejo, de 31 de marzo de 2004, relativa al establecimiento de normas de calidad y de seguridad para la donación, la obtención, la evaluación, el procesamiento, la preservación, el almacenamiento y la distribución de células y tejidos humanos (DO L 102 de 31.3.2004, p. 48, CELEX: https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=CELEX:32004L0023)
- Gee A. P. (2018). Producción de células CAR-T GMP. Buenas prácticas e investigación. Clinical haematology, 31(2), 126-134
- . Parte IV de las Directrices sobre buenas prácticas de fabricación de medicamentos de terapia avanzada (2017), publicadas en el volumen 4 de Eudralex
- Rafiq, S., Hackett, C. S., & Brentjens, R. J. (2020). Estrategias de ingeniería para superar los bloqueos actuales en la terapia con células T CAR. Nature reviews. Clinical oncology, 17(3), 147-167.






.png?width=109&height=108&name=Pharma%20(2).png)





.png)








