- verificar la coherencia de los parámetros de proceso existentes
- la exactitud de las especificaciones actuales tanto de las materias primas como de los productos acabados,
- y descubrir información específica para identificar mejoras en productos y procesos.
¿Por qué es importante llevar a cabo una Revisión Anual de la Calidad del Producto (APQR) en el sector farmacéutico?
La Revisión Anual de la Calidad del Producto no es sólo un requisito legal, sino que también permite a la empresa comprender mejor los procesos y tomar medidas de mejora para garantizar la calidad del producto.
En el sector farmacéutico, la APQR / PQR determina la necesidad de introducir cambios en el proceso de fabricación, los controles durante el proceso y las especificaciones. Se trata de identificar mejoras en el producto y el proceso de fabricación basadas en el análisis de tendencias y la evaluación de riesgos.
Los objetivos del PQR incluyen
-
Verificación del rendimiento del producto.
-
Coherencia del proceso de fabricación.
-
Determinación de la necesidad de revalidación de los procesos de fabricación.
¿Cuáles son las ventajas de una revisión de la calidad del producto (PQR)?
La APQR / PQR ayuda a identificar y priorizar las oportunidades de mejora, a comunicar a la dirección las recomendaciones de mejora derivadas de las revisiones de los productos y a cumplir los requisitos reglamentarios, así como a evaluar el estado de validación de los procesos. A continuación se enumeran algunas ventajas:
- Asegura la calidad del producto
Facilita el ajuste de especificaciones de procesos, materias primas y excipientes - Mejora de procesos
Ayuda a identificar áreas de mejora para ajustar procedimientos de procesamiento y control - Reducción de defectos de calidad
Mejor comprensión de los procesos de producción e identificación de tendencias - Identificación de riesgos potenciales debido a variaciones en procesos y materiales
- Cumplimiento con los requisitos de las autoridades regulatorias
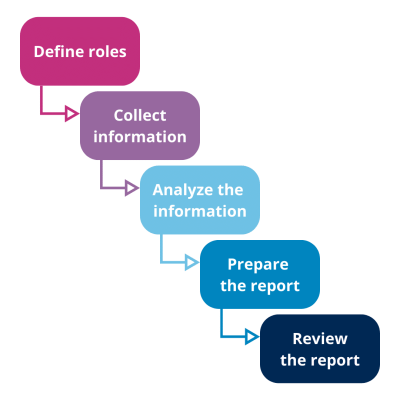
Etapas generales del proceso de revisión de la calidad del producto en farmacia
Elementos a tener en cuenta para la revisión de la calidad del producto
Detalles comunes para el APQR / PQR
- Identificación del producto
- Documentación; fórmula, especificaciones
- Lotes fabricados (aprobados, rechazados)
- Materiales crudos y de empaque
- Desviaciones, resultados fuera de especificación, retrabajo, rechazos, retiros, investigación, resolución y planes de acción asociados (CAPAs)
- Quejas, devoluciones y retiros
- Calificación de proveedores
- Atributos críticos de calidad y parámetros críticos del proceso
- Estado de calificación de áreas, equipos y sistemas y su impacto en la validación del proceso de producción y métodos analíticos
- Muestras de retención
- Resultados de estudios de estabilidad
- Actividades subcontratadas, acuerdos técnicos y contratos con terceros
- Controles de cambio / Cambios en las condiciones de registro
- Compromisos post-comercialización
- Reacciones adversas
- Acciones resultantes de APQR anteriores
- Acciones resultantes de las conclusiones de APQR
Elementos a considerar para el reporte
- Objetivo / Alcance
- Revisión de lotes procesados
- Revisión de Control de Cambios (considerar cambios de etiqueta y equipo / arte)
- Revisión de datos analíticos
- Revisión de datos de estabilidad
- Revisión de validación y calificación
- Revisión de no conformidades/desviaciones
- Revisión de lotes rechazados
- Revisión de lotes reprocesados
- Revisión de reclamaciones
- Revisión de retiros
- Revisión de contra-muestras
- Acuerdos de calidad
- Revisión de APRs anteriores
- Conclusiones y recomendaciones
- Referencias
- Aprobación
Principales retos a la hora de llevar a cabo una revisión de la calidad del producto (APQR / PQR) en el sector farmacéutico
Informes semanales de datos por lotes
Cada semana, debe obtener informes de datos por lotes, incluidos informes de producción, embalaje y otros. Recopilar datos sin procesar siempre es un esfuerzo; debe haber alguien responsable de obtener y recopilar toda la información.
A menudo, se trata de alguien del departamento de calidad, alguien que se centra en estas tareas, y también debe haber una planificación y gestión de las tareas y responsabilidades para que los datos, informes u otra información relacionada se entreguen según lo previsto.
Esto significa que tendrá que asignar a una o dos personas para que gestionen estas tareas.
Recuperación de datos con fines de evaluación
Otro reto a la hora de realizar un PQR es la recuperación de datos con fines de evaluación.
Si su empresa dispone de un sistema automatizado para obtener datos cualificados, puede utilizar su base de datos. Sin embargo, si no dispone de dicho sistema, la revisión de lotes individuales en papel para evaluar los parámetros del proceso, los controles del proceso, el análisis estadístico y el rendimiento del lote puede resultar engorroso y llevar mucho tiempo.
En ambos casos, los datos brutos utilizados para el análisis deben ser precisos para que el análisis y la evaluación sean eficaces. Si se encuentran desviaciones en el proceso durante la evaluación, puede ser necesario recopilar información adicional para justificar tales hallazgos.
Disponibilidad de datos para el gestor de PQR
Los datos deben estar disponibles para el gestor de PQR en todo momento y deben ser verificados por una segunda persona si se recopilan manualmente.
Hojas de cálculo validadas
Si se utilizan hojas de cálculo, deben ser validadas antes de su uso.
Consideraciones sobre la Revisión Anual de la Calidad del Producto (APQR / PQR) en Pharma
Revisión sistemática anual de la calidad
Se debe realizar una revisión sistemática anual de la calidad de cada producto. El departamento de control de calidad debe garantizar la implementación de la planificación de la PQR y designar a la persona responsable de su implementación y difusión.
- Los objetivos de la PQR son la verificación del rendimiento del producto, la consistencia del proceso de fabricación y la determinación de la necesidad de revalidación de los procesos de fabricación.
- El PQR determina la necesidad de cambios en el proceso de fabricación, controles en proceso y especificaciones. Esto incluye la identificación de mejoras en el producto y el proceso de fabricación basadas en el análisis de tendencias y la evaluación de riesgos.
- La agrupación de productos no está permitida, independientemente de que se utilicen procesos y equipos similares en su fabricación.
- Debe disponerse de un informe PQR para los medicamentos importados, que debe contener la información generada por el fabricante y debe complementarse con la información generada por los procesos llevados a cabo en el territorio nacional.
Procedimiento de implementación del PQR
Debe existir un procedimiento para implementar el PQR que incluya los objetivos para determinar y justificar las áreas seleccionadas para la revisión y el alcance potencial de la revisión.
Resumen formateado
Los resultados del PQR deben resumirse en un formato específico.
¿Por qué considerar la realización de su Revisión Anual de la Calidad del Producto (APQR / PQR) con el QbD Group?
-
No es necesario asignar personal propio a estas actividades. Recuerde: dependiendo de sus procesos, ¡puede que necesite asignar a una, dos o incluso tres personas para realizar las actividades de Revisión de la Calidad del Producto!
-
Diga adiós a las licencias de software para la revisión estadística. No necesita pagar licencias para todas las personas implicadas ni comprar software para el análisis de datos y la gestión estadística.
-
Facilítenos la información de Producción, Envasado, QA y QC, y nosotros le proporcionaremos los informes PQR, ya sean semanales, mensuales o anuales. Tenga la seguridad de que incluiremos puntos de mejora y gráficos de tendencias en el informe.
-
Los informes APQR estarán listos a tiempo. Olvídese de la programación de PQR, del seguimiento con las áreas afectadas y de los largos tiempos de espera. Nosotros lo haremos por usted.
-
Dispondrá de la información que necesite en cualquier momento, en una base de datos disponible 24/7.






.png?width=109&height=108&name=Pharma%20(2).png)





.png)