Marco normativo actual de la UE para titulares de MIA
- establecer un sistema de calidad farmacéutica
- disponer de personal y locales suficientes para las actividades en cuestión,
- tomar las medidas oportunas para gestionar las reclamaciones y la retirada de medicamentos,
- y aplicar procedimientos para controlar sus cadenas de suministro.
Nuevo anexo 21 sobre prácticas correctas de fabricación el 21 de agosto de 2022
El 21 de agosto de 2022 entrará en vigor el nuevo Anexo 21 de GMP, que describe los requisitos de GMP aplicables a los titulares de una Autorización de Importación de Fabricación (MIA) cuando importen medicamentos de fuera de la UE/EEE.
Solicitud
Es interesante señalar que este anexo se aplica a
- Medicamentos de uso humano
- Medicamentos de uso veterinario
- Medicamentos en investigación
No cubre los productos que no tienen autorización de comercialización en la UE/EEE y se reexportan directamente.
Interpretación del término importación
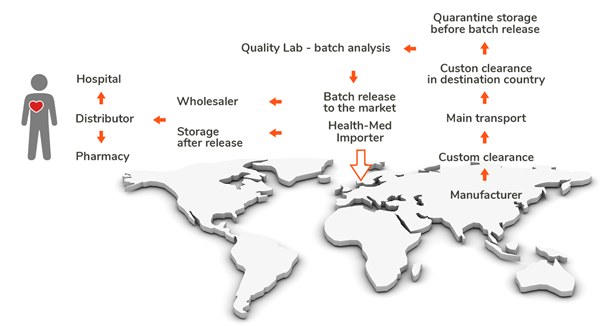
El documento ofrece una interpretación común del término importación, que se define como la introducción física de un medicamento desde fuera del territorio del EEE/UE. La liberación de lotes de medicamentos con QP sólo puede tener lugar tras la importación física y el despacho de aduanas en el Estado de la UE/EEE.
Centros con responsabilidades específicas
Los sitios que se considera que tienen responsabilidades específicas con respecto a la importación de un medicamento son:
- Lugar de importación física
- Sitio de certificación QP
Estos sitios se mencionan explícitamente en este Anexo 21, pero sólo pueden verse en relación con los demás actores de toda la cadena de suministro, entre ellos
- Fabricante del API
- Fabricante del medicamento en el tercer país
- Empresas de transporte implicadas
- Centro de pruebas de control de calidad de los productos importados
- Titular de la autorización de comercialización

Cuando no existe un acuerdo de reconocimiento mutuo (MRA), es un requisito legal probar cada lote en el momento de la importación a la UE antes de la certificación por un organismo de inspección competente y de la liberación de conformidad con el anexo 16 de la Guía GMP.
Los requisitos sobre el lugar en el que deben realizarse las pruebas ("en un Estado miembro") y los requisitos mínimos de las pruebas para los productos fabricados en terceros países se establecen en la letra b) del apartado 1 del artículo 51 de la Directiva 2001/83/CE para los medicamentos de uso humano y en la letra b) del apartado 1 del artículo 55 de la Directiva 2001/82/CE para los medicamentos veterinarios.
Referencia a la Guía Eudralex
El nuevo anexo hace referencia a otros capítulos y anexos pertinentes de Eudralex Guidance. Las responsabilidades relacionadas con la certificación por una QP y la liberación de lotes ya estaban claramente descritas en el anexo 16, pero este anexo 21 hace hincapié en la responsabilidad del titular de la autorización de comercialización (MAH) a lo largo de todo el ciclo de fabricación e importación de medicamentos.
Por ejemplo, la guía establece que para la certificación de una QP, el titular de la autorización de comercialización (MAH) debe tener acceso a la documentación completa del lote en todo momento.
Se trata de una práctica habitual, pero también señala el papel clave que debe desempeñar el titular de la autorización de comercialización a la hora de dar acceso a la QP a todos los documentos necesarios. El anexo establece explícitamente que la responsabilidad general de la comercialización de los medicamentos recae en el titular de la autorización de comercialización. Deben existir acuerdos por escrito entre los centros implicados.
Revisión de la calidad del producto
También hay algunas aclaraciones útiles sobre la Revisión de la Calidad del Producto (PQR), que ayudarán a la QP certificadora a supervisar adecuadamente todo el proceso. Como parte de esta revisión, los resultados analíticos del centro de pruebas de importación deben compararse con los del certificado de análisis preparado por el fabricante del tercer país.
El centro responsable de la certificación de la QP también debe asegurarse de que existe un programa de estabilidad en curso, aunque las pruebas puedan realizarse en un tercer país, siempre que la QP tenga acceso a los protocolos, resultados e informes de estabilidad pertinentes.
Evidentemente, en un mundo cada vez más globalizado, la fabricación de productos farmacéuticos y las cadenas de suministro pueden complicar el mantenimiento de una visión general de todo el proceso.
¿Por qué recurrir a un laboratorio contratado?
Si deseas importar medicamentos a la UE, necesitas un laboratorio de importación de la UE con acreditación QP y GMP. Crear un laboratorio de este tipo es caro en términos de inversión en infraestructura, equipos, personal, etc.
Al externalizar estas actividades, tendrás una idea clara de los costes por adelantado y tendrás acceso a nuestros expertos en control de calidad, garantía de calidad y control de calidad para la importación de medicamentos a la UE.
Quercus, su laboratorio GMP de confianza
Quercus Laboratories es miembro del grupo QbD y es un laboratorio GMP de confianza que apoya a la industria farmacéutica con una amplia gama de servicios de pruebas de control de calidad. Ofrecemos un servicio completo de pruebas de control de calidad químicas y microbiológicas de materias primas y productos farmacéuticos acabados.
Nuestras capacidades incluyen:
Validación de métodos analíticos - Liberación de lotes - Servicios de importación a la UE - Transferencias técnicas de métodos analíticos - Pruebas de lotes y certificados de análisis - Certificación de plantas de fabricación para el cumplimiento de las GMP de la UE - Revisión documental - Certificado de lote para liberación - Servicios de respaldo de QP - Estudios de estabilidad adicionales - Almacenamiento seguro de muestras de retención - Titular de MA - Apoyo en asuntos regulatorios: Redacción de expedientes CTD y solicitud de autorización de comercialización (CP/DCP/MRP/NP).






.png?width=109&height=108&name=Pharma%20(2).png)







.png)








