Cómo garantizar la calidad de los medicamentos y la seguridad de los pacientes
Para explicar la metodología de la calidad por diseño, es importante prestar atención primero a cómo se controla la calidad de los medicamentos. En la mayoría de los países, incluidos Bélgica y los Países Bajos, los gobiernos locales asignan instituciones para la auditoría de la calidad de los medicamentos. Los gobiernos son responsables de que las empresas farmacéuticas y biotecnológicas suministren productos seguros y de calidad. Sin embargo, no disponen del tiempo y los recursos necesarios para controlar todas las empresas del país de forma continua. Las auditorías son la solución. Las empresas son inspeccionadas cada tres o cinco años mediante una auditoría, para averiguar cómo garantizan la calidad de los productos y, por tanto, la seguridad de los pacientes.
Uno de los aspectos más importantes durante una auditoría de este tipo, es que no puede haber ninguna variación en los procesos de producción. Cuanta más variación, menos estables son los procesos y mayor es el riesgo de que la seguridad del paciente pueda estar en peligro. Pero, ¿cómo se excluye una posible variación? Por ejemplo, asegurándose de identificar todas las fuentes de variabilidad que pueden afectar a un proceso de producción. Además, también hay que explicar, investigar y gestionar estas fuentes de variabilidad, para asegurarse de que el producto final cumple las características predefinidas y, por tanto, es seguro.
La FDA y la metodología de calidad por diseño
A principios de los años cero, la Administración de Alimentos y Medicamentos de EE.UU introdujo la metodología de calidad por diseño para la industria farmacéutica. El concepto no era completamente nuevo; en aquel momento las directrices ya se utilizaban en la industria del automóvil desde hacía décadas. Desde los años cincuenta y sesenta, esta industria se enfrentaba a retos relacionados con la ampliación y los principios de "justo a tiempo" y "justo a la primera". Los fabricantes de automóviles no pueden permitirse interrumpir los procesos de producción y la cadena de suministro. Por eso necesitan asegurarse de que todos sus procesos cumplen un determinado nivel de calidad.
Por supuesto, en la industria farmacéutica existen otros riesgos. Y las directrices de calidad por diseño varían según el país. El Consejo Internacional para la Armonización de los Requisitos Técnicos de los Productos Farmacéuticos de Uso Humano (ICH) intenta trazar y armonizar todas las directrices locales. En sus directrices Q8, Q9 y Q10, el ICH describe el principio de calidad por diseño. Sin embargo, para muchas empresas es difícil llevarlo a la práctica. ¿Cómo se aplican las directrices correctamente y cómo se conectan las distintas partes de la metodología para aplicar de forma óptima la calidad por diseño como concepto?
Cómo poner en práctica la calidad por diseño
La idea de esta metodología es abordar los procesos de forma estructurada y científica. Para ello, hay que pasar por cuatro etapas diferentes. Estas etapas se suceden, pero no hay punto de partida ni de llegada; es un ciclo continuo. Vamos a profundizar un poco más en las cuatro etapas.
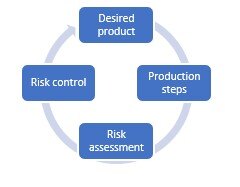
Producto deseado
Es importante hacerse una idea lo mejor posible del producto deseado, incluido el perfil de calidad del producto diana (QTPP). ¿En qué forma presentará el medicamento a los pacientes: será un fármaco de dosificación sólida oral (OSD), por ejemplo? De este modo, se verá obligado a determinar qué camino quiere seguir, para asegurarse de que los próximos pasos están claros para todas las partes implicadas.
Pasos de la producción
Además, tiene que determinar qué técnicas de producción piensa utilizar. Producir píldoras, por ejemplo, suele requerir el mismo proceso, relativamente estándar, pero otras formas pueden exigir técnicas más específicas. ¿Aún no está seguro del QTPP de su producto? Intente tomar decisiones con base científica para determinar su orientación preferida.
Evaluación de riesgos
En lugar de probar cada paso de sus procesos, es clave adoptar un enfoque basado en el riesgo. Esto significa que determinará si cada paso del proceso incluye ciertos riesgos para la seguridad del paciente, basándose en diversos análisis de riesgos. Normalmente, estos análisis se basarán en la literatura científica y en sus conocimientos y experiencia en proyectos farmacéuticos y biotecnológicos anteriores.
Para cada operación unitaria, tendrá que hacer una evaluación de dos factores importantes que pueden influir en los procesos. Los atributos críticos de calidad (CQA) son características químicas, biológicas o físicas que deben estar dentro de un determinado rango o límite para garantizar la calidad del producto. Los Parámetros Críticos del Proceso (CPP) son las variables clave que afectan al proceso de producción y sobre las que se puede influir, pero sólo ajustando un parámetro. Durante su evaluación de riesgos, realizará análisis basados en el riesgo de cada paso del proceso, para ver si influye en sus PCC. Si lo ha investigado para todo el proceso de producción, podrá elaborar un mapa térmico para determinar los mayores riesgos de calidad dentro de todo el proceso.
Control de riesgos
En resumen, hemos dicho que se utiliza el QTPP para determinar el producto final que se desea obtener, a partir de ahí se determinan los pasos y técnicas de producción necesarios para fabricar el producto, y se traza un mapa de cómo influye en los CQA del producto por paso de producción.
El cuarto paso consiste en ponerse manos a la obra con las partes de su proceso de producción que presentan un alto riesgo en lo que respecta a la calidad y, por tanto, a la seguridad del paciente. Utilizando un diseño de experimento, o un diseño de prueba estadística, se obtiene una visión de cómo una combinación de factores afectará a un proceso y a su resultado. A continuación, puede crear otro mapa de calor que responda a la pregunta: ¿cuáles son los límites superior e inferior para controlar la calidad de mi producto en función de diversos parámetros? Esto le permite tomar medidas inmediatas durante el proceso de producción si descubre que los parámetros o atributos están a punto de superar los límites superior o inferior.
Ventajas e inconvenientes
Una de las mayores ventajas de la metodología de calidad por diseño, en comparación con otros métodos de calidad, es que usted sabe lo que está ocurriendo durante todas las fases del proceso y puede vigilar de cerca los riesgos potenciales. Cuando se trabaja sin la metodología de calidad por diseño, es posible que se hayan seguido todos los pasos correctos del proceso, pero que la calidad del producto no sea la adecuada en la inspección final porque algo ha ido mal.
Una desventaja de esta metodología es que, como seres humanos, no estamos acostumbrados a gestionar los riesgos. Ilustrémoslo con un ejemplo. Basándose en la metodología de calidad por diseño, una empresa farmacéutica estimó que determinados aspectos del proceso de producción eran de alto riesgo. Pusieron mucho empeño en estos aspectos para comprenderlos y controlarlos. Durante una auditoría gubernamental, el auditor decide omitir los aspectos de alto riesgo porque confía en que la empresa ha hecho todo lo posible para controlarlos. En cambio, decide centrarse en los riesgos bajos, pero no es consciente de que estos riesgos bajos tienen menos impacto. Al fin y al cabo, se trata de la seguridad del paciente. Es importante darse cuenta de que, como empresa, hay que actuar con pragmatismo a la hora de analizar y controlar los riesgos.
¿Necesitas ayuda en relación con la metodología de calidad por diseño?
Para las empresas de los sectores de las ciencias de la vida, la sanidad, los productos sanitarios o cualquier otro muy regulado, el principio de calidad mediante el diseño puede aportar un gran valor añadido a la estrategia general de control de procesos y productos. Nuestros consultores estarán encantados de ayudarte a aplicar eficazmente la metodología de calidad por diseño a tus procedimientos y procesos. Te ayudamos a establecer un análisis y un enfoque estratégicos, a aplicar las herramientas adecuadas y a formar a tus empleados de la manera correcta. ¿Quieres saber más? Ponte en contacto con nosotros.






.png?width=109&height=108&name=Pharma%20(2).png)





.png)








