Los productos sanitarios a medida son los más extraños en lo que respecta al Reglamento (UE) 2017/745 sobre productos sanitarios.
El MDR menciona "productos distintos de los hechos a medida" 10 veces y "productos distintos de los hechos a medida" 1 vez. Además, un anexo específico del MDR está dedicado a los productos a medida (anexo XIII).
En este artículo explicaremos
- por qué es así,
- qué se incluye en la definición de productos sanitarios a medida,
- y lo que esto significa en la práctica para sus productos específicamente (aspectos destacados y áreas de interés).
¿Qué significa "hecho a medida" según el MDR?
El reglamento cita lo siguiente:
"producto a medida": todo producto fabricado específicamente con arreglo a una prescripción escrita de cualquier persona autorizada por la legislación nacional en virtud de las cualificaciones profesionales de dicha persona que le confiera, bajo su responsabilidad, características específicas de diseño, y que esté destinado al uso exclusivo de un determinado paciente para satisfacer exclusivamente sus condiciones y necesidades individuales.
No obstante, no se considerarán productos a medida los productos fabricados en serie que deban adaptarse para satisfacer las necesidades específicas de cualquier usuario profesional, ni los productos fabricados en serie mediante procesos de fabricación industrial de conformidad con las prescripciones escritas de cualquier persona autorizada;
Si lees esto como fabricante, parece una zona bastante gris. El segundo párrafo es especialmente confuso.
Orientaciones de la IMDRF y el MDCG
Afortunadamente, en marzo de 2020 y marzo de 2021, respectivamente, el IMDRF (Foro Internacional de Reguladores de Dispositivos Médicos) y el MDCG (Grupo de Coordinación de Dispositivos Médicos) escribieron una serie de documentos de orientación:
- El IMDRF escribió el "Personalized Medical Devices - Regulatory Pathways";
- y el MDCG redactó el documento "MDC 2021-3 Questions and Answers on Custom-Made Devices".
La IMDRF ofrece más detalles sobre las diferencias entre dispositivos hechos a medida, adaptados al paciente y adaptables. Véase su práctico árbol de decisiones a continuación:
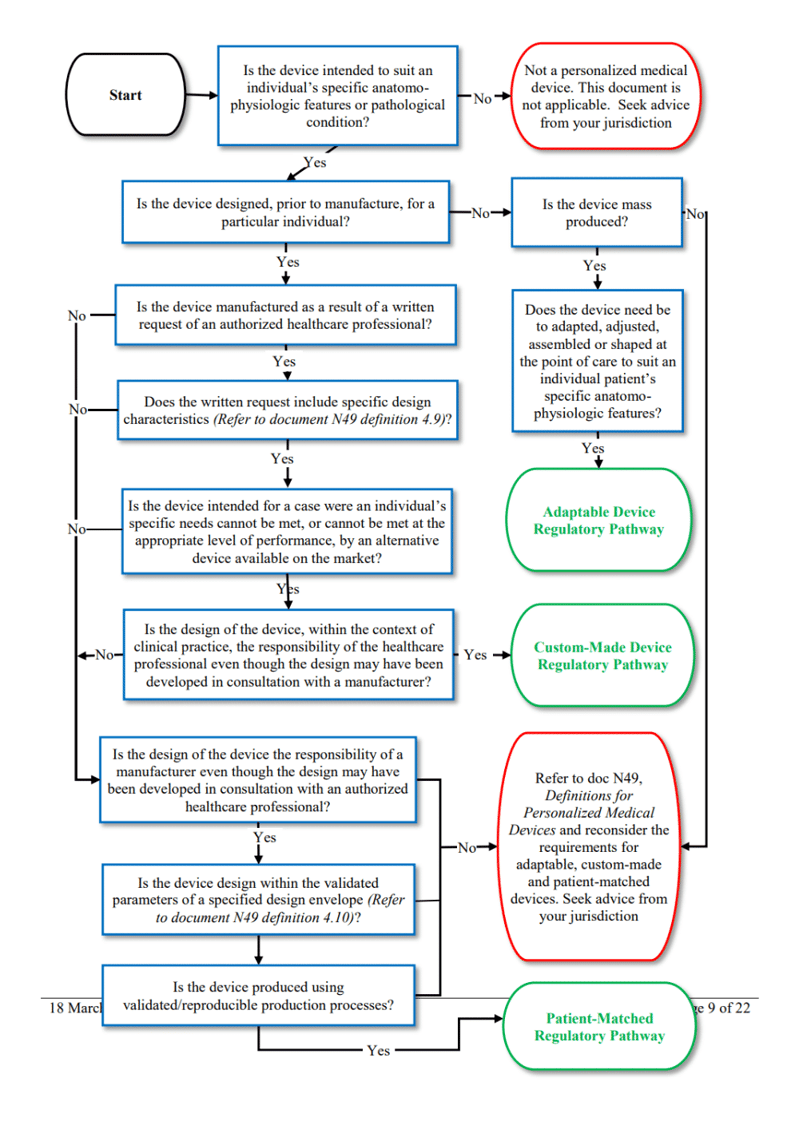
Figura 1 - Árbol de decisiones del IMDRF sobre las diferencias entre dispositivos hechos a medida, adaptados al paciente y adaptables
El MDCG hace referencia al documento del IMDRF y aborda las cuestiones planteadas en él, pero más bien intenta analizar la definición del MDR y ofrece ejemplos concretos.
Estas dos herramientas deberían darle una buena idea de cómo puede definirse su producto. Y si quedan dudas, se puede consultar al organismo notificado o a la autoridad competente.
¿Por qué los productos sanitarios a medida son la excepción?
¿Por qué los productos sanitarios a medida parecen tan diferentes de otros productos en la MDR? Con la Directiva de Productos Sanitarios (MDD), las tecnologías más recientes, como la fabricación aditiva y la fabricación sustractiva, no estaban cubiertas y podían permanecer fuera del radar reglamentario.
La ventaja era que muchos pacientes con necesidades muy específicas recibían una atención adaptada y personalizada. La desventaja era que los dispositivos implantables de alto riesgo tampoco estaban cubiertos por la normativa, con todos los riesgos que ello conllevaba para el paciente.
¿Cuál era entonces el objetivo de la MDR? Poder cubrir estos dispositivos específicos para cada paciente y hechos a medida desde el punto de vista reglamentario, pero sin provocar una disminución de la producción o del número de fabricantes para estos pacientes.
Porque, al fin y al cabo, para muchos de estos pacientes no existen otras alternativas. Y entonces todo se reduce a si el beneficio supera a los riesgos.
¿Qué debe tener en cuenta un fabricante de dispositivos a medida?
¿Qué NO necesita?
Mientras que todos los productos no personalizados requieren documentación técnica (anexos II y III del MDR), incluida la evaluación clínica, los productos a medida están exentos de ella.
Con ello se pretende evitar que un producto no fabricado en serie requiera mucho trabajo y que los fabricantes se muestren reacios a desarrollar productos a medida.
Los productos a medida están exentos de adherirse al sistema de identificación única de productos (UDI). Sin embargo, es crucial tener en cuenta que estos productos deben mantener un nivel de trazabilidad, que puede lograrse mediante la utilización de un sistema de codificación específico, por ejemplo.
Los productos a medida no están obligados a registrarse en la Base de Datos Europea de Productos Sanitarios (EUDAMED), lo que ofrece una mayor flexibilidad reglamentaria.
Para cumplir la normativa, los productos a medida deben tener una Declaración, tal y como se define en el Reglamento de Productos Sanitarios (MDR), concretamente en el Anexo XIII, sección 1. No debe confundirse con la Declaración de Productos Sanitarios. Esto no debe confundirse con la Declaración de Conformidad, que no es un requisito previo para los productos a medida.
Además, los productos a medida no pueden llevar la marca CE, lo que indica que no se han sometido a los procedimientos estándar de evaluación de la conformidad aplicables a los productos fabricados en serie.
¿Qué SÍ necesita?
Esto no significa que estén exentos de otras normativas. El anexo XIII del MDR está dedicado específicamente a los productos sanitarios a medida.
El punto principal de este anexo es que el fabricante debe pensar detenidamente en el prescriptor y sus cualificaciones.
Debe tener en cuenta la trazabilidad del producto: documentar la información sobre el diseño, el proceso de fabricación y el funcionamiento del producto y tomar medidas para garantizar que el proceso de fabricación es el especificado.
El fabricante también está obligado no sólo a centrarse en las consideraciones previas a la producción, sino también a incorporar los conocimientos y la experiencia obtenidos durante la fase posterior a la producción.
En la práctica, esto requiere la formulación de un plan y un informe exhaustivos de vigilancia postcomercialización. Para garantizar la máxima seguridad y fiabilidad de su producto, se recomienda encarecidamente basar sus estrategias de PMS en las directrices descritas en los artículos 83 a 85 del Reglamento de Productos Sanitarios (MDR).
En caso de incidentes graves o acciones correctivas de seguridad sobre el terreno, es obligatoria una comunicación rápida con las autoridades competentes pertinentes. Se trata de un paso fundamental para garantizar que cualquier problema de seguridad se aborde de inmediato y que se apliquen rápidamente medidas correctoras.
En cuanto a la documentación de cumplimiento, debe redactarse meticulosamente y actualizarse con regularidad una declaración como la especificada en el anexo XIII del MDR. Este documento debe permanecer fácilmente disponible para su inspección por parte de las autoridades competentes. Además, también debe ser accesible para el paciente o usuario específico para el que se diseñó y fabricó el producto a medida.
Especificaciones adicionales para los implantables a medida de clase III
Como ya se ha mencionado, los productos sanitarios a medida de alto riesgo eran la principal preocupación de los reguladores. Para hacer frente a estos riesgos, los reguladores añadieron un requisito adicional para los productos implantables a medida de clase III. Concretamente, en la evaluación de la conformidad, deben seguir.
Además de cumplir las especificaciones detalladas en el anexo XIII, los fabricantes deben someterse a una evaluación de la conformidad. Las dos vías principales para esta evaluación consisten en adherirse a las directrices establecidas en el Anexo IX, Capítulo I, o seguir el Anexo XI, Parte A.
Anexo IX, Capítulo I: Enfoque del Sistema de Gestión de la Calidad
Optar por esta ruta puede parecer sencillo y puede parecer sinónimo de someterse a una auditoría ISO 13485. Sin embargo, implica más complejidades de las que uno podría anticipar inicialmente. Los fabricantes están obligados a proporcionar pruebas que abarquen diversos ámbitos, como la vigilancia posterior a la comercialización, el seguimiento clínico posterior a la comercialización y la evaluación clínica. Esto se extiende también a los detalles relacionados con el proceso de diseño y fabricación, así como a las cualificaciones del personal involucrado. En esencia, este enfoque es muy similar a los requisitos para la Documentación Técnica descritos en el Anexo II del MDR.
Anexo XI, Parte A: Enfoque de Quality Assurance de la producción
Si bien rara vez se elige esta vía para la evaluación de la conformidad, especialmente porque ofrece menos flexibilidad, no debe confundirse con que requiere menos esfuerzo, especialmente para los dispositivos implantables hechos a medida de Clase III. Debido a la complejidad de la normativa del Anexo XI y a su selección menos frecuente por parte de los fabricantes, en esta entrada del blog no se profundizará en una explicación detallada. Sin embargo, nuestros consultores de Calidad por Diseño (QbD) están disponibles para proporcionar más información y aclarar cualquier pregunta que puedas tener.
NOTA IMPORTANTE
Una distinción fundamental para los productos implantables a medida de la clase III es la participación obligatoria de un organismo notificado para la supervisión reglamentaria, que los diferencia de otras clases de productos a medida. Estos productos deben someterse a una evaluación de conformidad específica que es objeto de una auditoría rigurosa por parte de un organismo notificado. Si está contemplando cómo proceder con esto, la solicitud debe presentarse bajo la categoría de "Auditoría sobre la evaluación de la conformidad según el anexo IX o el anexo XI para productos sanitarios implantables a medida de la clase III".
Si su objetivo es que un Organismo Notificado expida el certificado ISO 13485 y otro conceda la aprobación de comercialización con arreglo al Reglamento de Productos Sanitarios (MDR), entonces su camino a seguir es doble:
-
Certificación ISO 13485: El primer paso es solicitar la certificación ISO 13485 para garantizar que su sistema de gestión de la calidad cumple las normas internacionales exigidas para los productos sanitarios.
-
Evaluación de la conformidad MDR: Simultáneamente, puede solicitar una evaluación de conformidad basada en el anexo IX, capítulo I, o en el anexo XI, parte A, del MDR. Esta evaluación se centrará en los requisitos reglamentarios específicos de los productos sanitarios implantables a medida de clase III y será realizada por un organismo notificado.
Al dar estos dos pasos, puede asegurar tanto su certificación ISO 13485 como la aprobación de mercado según el MDR, garantizando así que su dispositivo implantable a medida de Clase III cumple todas las normas reglamentarias y los puntos de referencia de calidad necesarios.
Conclusiones generales
- Los dispositivos hechos a medida no necesitan estar cubiertos por el sistema UDI. Pero tenga en cuenta que todavía deben rastrearse mediante el uso de un código, por ejemplo;
- No es necesario registrarse en EUDAMED;
- Los productos fabricados a medida requieren una declaración (véase el anexo XIII, sección 1), pero no una declaración de conformidad;
- Los dispositivos hechos a medida no tienen el marcado CE;
- Asegúrese de tener una lista de todos los dispositivos hechos a medida en caso de que la autoridad competente lo solicite (vendidos en su territorio);
- Añádase las palabras «dispositivo a medida» en la etiqueta.
- Y, por último, nunca olvide la clasificación de su dispositivo. El hecho de que el dispositivo entre en la definición de "hecho a medida" no significa que esté exento de clasificación. Aun así, debe proporcionar una justificación de la clasificación, junto con una explicación de por qué el dispositivo está hecho a medida. Esto dará como resultado una Clase I hecha a medida; Clase IIa hecho a medida; Clase IIb producto sanitario a medida o Clase III a medida.
Conclusión
Históricamente, los dispositivos hechos a medida quedaban fuera del ámbito de aplicación de la Directiva de Dispositivos Médicos, lo que daba lugar a un panorama de mercado en el que ciertos dispositivos escapaban al escrutinio reglamentario, planteando así riesgos potenciales para la seguridad del paciente. Reconociendo esta laguna reglamentaria, las autoridades de la Unión Europea se propusieron incluir estos dispositivos en el ámbito del nuevo Reglamento de Productos Sanitarios (MDR 2017/745).
Es importante destacar que la intención no era reducir la presencia de dispositivos a medida en el mercado mediante la imposición de obstáculos reglamentarios onerosos. Para lograr este equilibrio, los reguladores elaboraron todo un anexo en el MDR dedicado específicamente a estos dispositivos. El resultado es un marco reglamentario más riguroso que antes, pero que sigue siendo manejable para los fabricantes.
Sin embargo, en el caso de los productos implantables a medida de la clase III, las dificultades aumentan considerablemente debido a la participación obligatoria de un organismo notificado. A ello se suma la extensa documentación necesaria, que añade niveles de complejidad al proceso de cumplimiento de la normativa.
A medida que el campo de los productos sanitarios sigue evolucionando, las tecnologías emergentes introducen nuevos retos que los reguladores deben abordar. El MDR proporciona algunas herramientas básicas para supervisar los productos a medida, pero a medida que avanza la innovación, surgen nuevos obstáculos.
Si te encuentras navegando por este complejo panorama, los expertos en reglamentación de QbD Group tienen experiencia especializada en productos a medida. Estamos bien equipados para ayudarte a lograr el pleno cumplimiento de los estrictos requisitos del MDR, garantizando tanto el acceso al mercado como la seguridad del paciente.






.png?width=109&height=108&name=Pharma%20(2).png)





.png)








