Los plásmidos se utilizan en diversas aplicaciones de investigación y biotecnología, como la terapia génica, el desarrollo de vacunas y la producción de proteínas recombinantes.
Tanto si eres fabricante como usuario de plásmidos, necesitas tener conocimientos específicos sobre la fabricación de plásmidos y la normativa antes de salir al mercado.
En este blog se analizan los principios básicos de la fabricación de plásmidos y la normativa correspondiente.
¿Qué son los plásmidos?
Los plásmidos son pequeños fragmentos circulares de ADN que se encuentran en bacterias y otros organismos. Pueden replicarse independientemente del genoma del huésped y portan genes que le proporcionan ciertas ventajas, como la resistencia a los antibióticos o la capacidad de metabolizar nutrientes específicos.
El proceso exacto por el que se crean los plásmidos puede variar en función de las circunstancias, pero en general implica los siguientes pasos:
1. Adquisición de ADN extraño
Los plásmidos pueden adquirir ADN extraño a través de una variedad de mecanismos, como la transformación (absorción de ADN desnudo del medio ambiente), la transducción (transferencia de ADN a través de bacteriófagos) o la conjugación (transferencia directa de ADN entre bacterias).
2. Integración del ADN extraño
Una vez que la bacteria ha adquirido el ADN extraño, necesita integrarlo en el plásmido. Esto puede suceder a través de una variedad de mecanismos, como la recombinación homóloga o la transposición.
3. Replicación
Los plásmidos pueden replicarse independientemente del genoma del huésped, lo que significa que pueden existir en múltiples copias dentro de una sola célula bacteriana. El plásmido permanece en la bacteria y sus descendientes.
4. Mantenimiento
Los plásmidos deben ser capaces de mantenerse dentro de una población bacteriana para persistir en el tiempo. Esto puede implicar mecanismos como la selección de células que contienen plásmidos o la producción de factores que aseguran su propia replicación y estabilidad.
La creación de plásmidos implica una compleja interacción entre el propio plásmido y su huésped bacteriano, así como la adquisición e integración de ADN extraño.

Figura 1- Estructura general de un plásmido (fuente: referencia 1)
Aumento de la cantidad: Fabricación de plásmidos
La fabricación de plásmidos se refiere al proceso de producir enormes cantidades de una secuencia específica de ADN plasmídico para su uso en investigación o aplicaciones biotecnológicas. El proceso implica varios pasos, que pueden variar en función del plásmido específico y del uso previsto.
Existen múltiples métodos para el almacenamiento de plásmidos, entre ellos:
1. Diseño
El primer paso en la fabricación de plásmidos es diseñar la secuencia. Esto implica seleccionar los elementos genéticos apropiados (como promotores, secuencias reguladoras, genes de resistencia a los antibióticos y marcadores seleccionables) y organizarlos de manera que permitan que el plásmido exprese los genes deseados y confiera los rasgos deseados a la célula huésped.
2. Clonación
Una vez diseñada la secuencia, se debe clonar en un vector adecuado, como un plásmido bacteriano o un vector viral. Esto generalmente se hace utilizando la tecnología de ADN recombinante, que consiste en cortar el ADN plásmido y vectorial con enzimas específicas y luego unirlos.
3. Transformación de la célula huésped
El ADN plasmídico recombinante resultante se introduce en una célula huésped, generalmente una célula bacteriana como E. coli. La célula huésped se transforma con el plásmido utilizando métodos como la electroporación, el choque térmico o la transformación química. Se crean colonias de las bacterias que contienen plásmidos para la creación de bancos de células maestras (MCB), consulte la sección a continuación "Construcción de las reservas: bancos de plásmidos". En su mayoría, los bancos de células de trabajo (WCB) se crean para permitir la fabricación de un solo plásmido.
4. Amplificación
Una vez que el plásmido se ha introducido en la célula huésped (y se crea el MCB y/o WCB), debe amplificarse para producir enormes cantidades de la secuencia de ADN. Un vial del MCB o WCB se descongela y se procesa posteriormente para comenzar la amplificación del plásmido. Se pueden utilizar varios métodos, como la fermentación o el cultivo en matraces agitados. Durante este paso, las células huésped crecen en un medio rico en nutrientes que les permite multiplicarse y producir múltiples copias. Dado que el plásmido tiene un gen de resistencia a los antibióticos, el medio contiene antibióticos como la kanamicina, por lo que solo el plásmido que contiene E. Coli puede crecer.
5. Purificación
Una vez que las células huésped han crecido y producido el ADN plasmídico, el ADN se extrae y purifica de las células y otros componentes celulares. Esto generalmente implica varias rondas de purificación, como lisis alcalina, cromatografía en columna y precipitación.
6. Control de calidad
Finalmente, el ADN plasmídico purificado se somete a pruebas de control de calidad para garantizar que esté puro, intacto y libre de contaminantes. Estas pruebas pueden incluir electroforesis en gel, espectrofotometría y secuenciación.
El ADN plasmídico resultante puede utilizarse en diversas aplicaciones de investigación y biotecnología, como la terapia génica, el desarrollo de vacunas y la producción de proteínas recombinantes.

Figura 2- Visión general de la fabricación de plásmidos (fuente: referencia 2)
Creación de reservas: banco de plásmidos
Sin embargo, antes de la amplificación durante la fermentación, se selecciona una colonia que contenga plásmidos para la creación de un banco celular maestro (MCB). Esto se denomina banco de plásmidos. Por banco de plásmidos se entiende el proceso de conservación y almacenamiento de plásmidos para su uso futuro. Esto es importante para la investigación y las aplicaciones biotecnológicas, ya que permite a los científicos acceder y utilizar plásmidos específicos en un momento posterior, sin tener que repetir todo el proceso de fabricación de plásmidos.
Existen múltiples métodos para el almacenamiento de plásmidos, entre ellos:
1. Liofilización
En este método, el ADN del plásmido se disuelve en una solución tampón y luego se liofiliza para eliminar toda el agua. El polvo resultante puede almacenarse a temperatura ambiente y reconstituirse con agua cuando sea necesario.
2. Almacenaje con glicerol
En este método, el ADN plasmídico se mezcla con un crioprotector como el glicerol y luego se congela a -80 °C. Esto permite que el plásmido se almacene durante largos períodos de tiempo sin degradación.
3. Método de la ampolla
En este método, el ADN plasmídico se mezcla con un crioprotector y luego se almacena en pequeñas ampollas de vidrio, que se sellan al vacío y luego se congelan a -80 ° C.
4. Almacenamiento basado en perlas
En este método, el ADN plasmídico se inmoviliza en pequeñas perlas de sílice o vidrio, que luego se almacenan en un entorno desecado o de nitrógeno. Este método permite el almacenamiento y la recuperación de plásmidos de manera fácil y eficiente.
Independientemente del método de almacenamiento utilizado, el almacenamiento de plásmidos requiere una documentación y un seguimiento minuciosos para garantizar que los plásmidos puedan localizarse y recuperarse fácilmente cuando sea necesario. Esto incluye información sobre la secuencia, la fecha de creación, el lugar de almacenamiento y cualquier dato relevante sobre el control de calidad.
Requisitos reglamentarios para la fabricación
En 2018, la EMA publicó una directriz específica sobre la calidad y los aspectos no clínicos y clínicos de los medicamentos de terapia génica y definió los plásmidos como materiales de partida (4).
Los principios de las Buenas Prácticas de Fabricación (GMP) para la fabricación de materiales de partida de origen biológico utilizados para transferir material genético para la fabricación de ATMP requieren que los procesos de fabricación de plásmidos estén bien caracterizados, controlados y validados para garantizar la consistencia y la calidad del producto final. El proceso de fabricación debe estar diseñado para minimizar el riesgo de contaminación o degradación del plásmido durante todas las etapas de producción, desde el banco de células hasta la purificación final.
La EMA también exige que se analicen los plásmidos para garantizar su identidad, pureza, potencia y seguridad. Esto incluye pruebas para detectar la presencia de impurezas como ADN residual de células huésped, endotoxinas y agentes adventicios, así como para evaluar la estabilidad y potencia de los plásmidos.
Además, la EMA publicó un documento sobre las preguntas y respuestas sobre los principios de las BPF para la fabricación de materiales de partida de origen biológico utilizados para transferir material genético para la fabricación de ATMP en 2021(5). En este documento, la EMA afirma que es necesaria una evaluación basada en el riesgo para determinar los principios de GMP para los materiales de partida en la producción de ATMP. Además, no se requiere una persona cualificada (QP) en relación con la fabricación de materiales de partida.
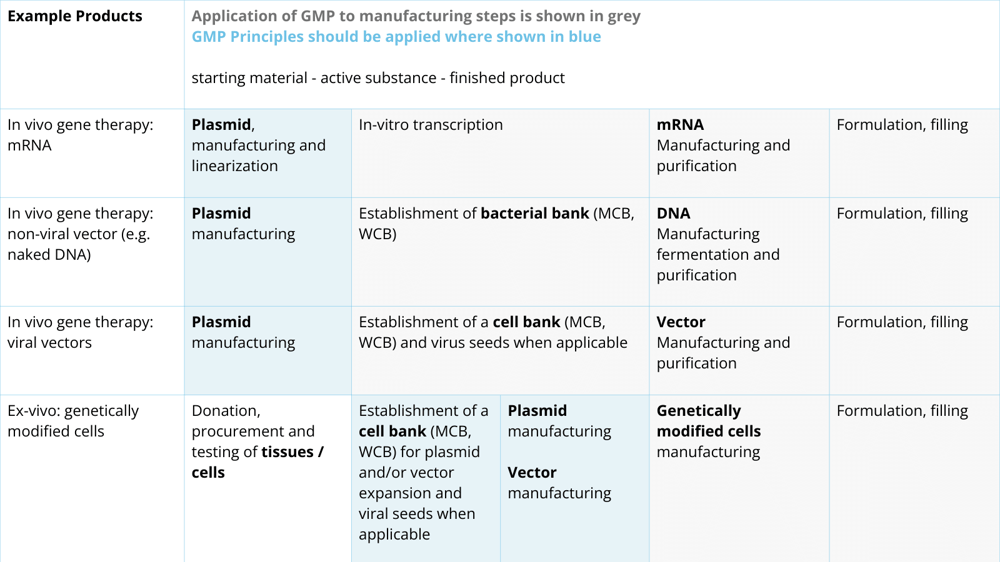
En este documento, la EMA publicó una tabla (véase la Figura 3) para ayudar a comprender los requisitos de las GMP para diversos productos que utilizan plásmidos. Los campos en gris claro muestran dónde deben aplicarse los principios de las GMP, y los campos en gris oscuro muestran dónde deben aplicarse los procedimientos completos de las GMP. La EMA habla de utilizar un enfoque basado en el riesgo para determinar qué nivel de GMP se requiere y que éste debe ser proporcional al impacto del material de partida en la calidad, seguridad y eficacia del producto acabado.
Como puede deducirse de la tabla de la figura 3, los fabricantes de ATMP deben cumplir los procedimientos de las GMP, pero los fabricantes de plásmidos deben seguir los principios de las GMP. Por lo tanto, es importante que los fabricantes de ATMP cualifiquen a los fabricantes de plásmidos para asegurarse de que se les suministran plásmidos de alta calidad adecuados para el uso previsto en la producción de ATMP.
En el caso de EE.UU., la FDA, Food and Drug Administration, publicó en 2020 una directriz que proporciona información sobre química, fabricación y control (CMC) para las solicitudes de nuevos fármacos en investigación (IND) de terapia génica humana (6). La clasificación de los plásmidos utilizados en los procesos de terapia celular y génica sigue siendo un área más ambigua en cuanto a su clasificación (es decir, material auxiliar, materia prima, material de partida o intermediario de sustancias farmacológicas).
Los plásmidos deben crearse a partir de bancos cualificados y la información sobre los materiales utilizados en la creación de estos bancos debe documentarse en el IND. Además, para la fase inicial, la creación de bancos de células maestras no es necesaria. Sin embargo, toda la información sobre los materiales de partida para crear el banco debe describirse en el IND.
Para determinar la calidad de los plásmidos, deben someterse a pruebas de pureza, endotoxina, esterilidad e identidad, entre otras. Además, el banco de células maestras debe ser analizado al menos para detectar la presencia del plásmido, la identificación de la cepa huésped bacteriana, el recuento de células, la identificación del plásmido, la secuencia del plásmido y la pureza de la cepa huésped. Pueden ser necesarias otras pruebas analíticas dependiendo de los requisitos para el uso del plásmido.
Conclusión
La fabricación de plásmidos es un proceso complejo que implica varios pasos, como el diseño, la clonación, la transformación de la célula huésped, la amplificación del plásmido, la purificación y el control de calidad.
El plásmido resultante puede conferir una amplia gama de aplicaciones en investigación y biotecnología, como la terapia génica, el desarrollo de vacunas y la producción de proteínas recombinantes. Una parte del proceso de fabricación es el almacenamiento de plásmidos, que permite acceder a plásmidos específicos y utilizarlos posteriormente.
Existen diferentes directrices para regular el uso de plásmidos en productos de terapia génica y garantizar que se utilicen de forma segura y eficaz en beneficio de los pacientes.
La directriz de la EMA de 2018 y las preguntas y respuestas de seguimiento de 2021 (4,5), aclararon los principios de BPF en la fabricación de plásmidos y describieron el enfoque basado en el riesgo para determinar el nivel de BPF en función del impacto del material de partida en la calidad, seguridad y eficacia del medicamento terminado.
El fabricante de ATMP debe cumplir los procedimientos de las GMP, pero el fabricante de plásmidos debe cumplir los principios de las GMP. Por tanto, es importante que el fabricante de ATMP cualifique al fabricante del plásmido para garantizar la calidad del plásmido y, por tanto, del producto final.
La FDA, por su parte, definió los plásmidos como productos intermedios y no estableció requisitos específicos de PCF para su fabricación (6). Establece que los plásmidos deben crearse a partir de bancos cualificados y que toda la información sobre los materiales utilizados en la creación de estos bancos debe figurar en el IND. Además, la directriz proporciona una lista recomendada de pruebas analíticas para determinar la calidad del plásmido y de los bancos de plásmidos.
- https://www.genome.gov/genetics-glossary/Plasmid
- Implicaciones normativas y de la cadena de suministro para los plásmidos como materiales de partida críticos en la fabricación de productos de terapia génica con vectores virales por Melissa Gosse, Cameron Jones, Desyree Jesus y Susan D'Costa
- Directrices sobre prácticas correctas de fabricación específicas para medicamentosde terapia avanzada
- Agencia Europea de Medicamentos, 22MAR2018, EMA/CAT/80183/2014, Comité de Terapias Avanzadas (CAT), Directriz sobre la calidad y los aspectos no clínicos y clínicos de losmedicamentos de terapia génica.
- Preguntas y respuestas sobre los principios de GMP para la fabricación de materiales de partida de origen biológico utilizados para transferir material genético para la fabricación de ATMPs
- Información sobre química, fabricación y control (CMC) para solicitudes de nuevos medicamentos en investigación (IND)de terapia génica humana






.png?width=109&height=108&name=Pharma%20(2).png)





.png)