Imagina un mundo en el que innumerables operarios controlan meticulosamente diales e interruptores para garantizar la producción precisa de productos farmacéuticos que salvan vidas. Este escenario de trabajo intensivo y propenso a errores fue una vez una realidad...
Hoy en día, sin embargo, los sistemas de automatización SCADA orquestan una sinfonía de automatización, garantizando tanto la eficiencia como el cumplimiento normativo en la fabricación de productos farmacéuticos.
¿Sientea curiosidad por saber cómo consiguen los sistemas SCADA este extraordinario logro? En esta entrada de blog, aprenderás más sobre la automatización SCADA y la validación SCADA en el sector farmacéutico.
¿Qué es un sistema informatizado?
Antes de sumergirnos en el mundo de los sistemas SCADA informatizados, establezcamos una base común definiendo un sistema informatizado según GAMP5.
Se trata de un sistema que engloba uno o varios ordenadores y su correspondiente software, componentes de red, las funciones que controlan y toda la documentación pertinente.
En términos más sencillos, es la integración armoniosa de hardware y software, que trabajan conjuntamente con los procesos para los que están diseñados dentro de su entorno operativo.
¿Qué es un sistema SCADA?
SCADA, siglas de Supervisory Control And Data Acquisition, es un sistema que utiliza software para centralizar la recepción de señales procedentes de diversos sensores y equipos.
Esto facilita la automatización de la adquisición de datos, la supervisión y el control remoto de los procesos industriales. Esto se consigue mediante la combinación de varios componentes.
Componentes del sistema
-
-
Instrumentación y armarios eléctricos
-
Hardware:
-
Infraestructura de red
-
Controladores lógicos programables (PLC)
-
PC cliente/servidor
-
Servidores físicos
-
-
Programas informáticos:
-
Control PLC
-
SCADA
-
Software de control por lotes
-
-
Relevancia de la automatización SCADA
Antes de la automatización industrial, todos los controles eran manuales. Esto requería un número considerable de operarios, lo que encarecía los costes. Afortunadamente, la automatización ha evolucionado considerablemente en el último siglo.
Hoy en día, las operaciones racionalizadas se consiguen mediante PLC y sistemas SCADA. Los PLC son ordenadores especializados dedicados a gestionar, controlar, almacenar y transmitir datos para supervisar los procesos de producción.
Software de control de lotes
Junto con el software SCADA, que destaca en el control de sistemas en tiempo real, el software de control de lotes desempeña un papel vital en la automatización y gestión de recetas de producción.
Estas recetas proporcionan instrucciones estructuradas para controlar varios PLC y sus componentes asociados de forma secuencial.
Aunque el software SCADA y el de control de lotes pueden integrarse a veces en el mismo programa o módulos, es importante recordar que tienen propósitos distintos.
Componentes del sistema
- PLC (controlador lógico programable): Ordenador especializado encargado de gestionar sensores o equipos. Puede programarse localmente desde interfaces hombre-máquina (HMI).
- Software de control de lotes: Este software facilita la creación de recetas para el control ordenado y automatizado de los PLC.
- Software SCADA: Proporciona una supervisión continua y permite realizar ajustes manuales de los parámetros del PLC.
- Interfaces hombre-máquina (HMI)
Las HMI de los PLC permiten a los operarios controlar las máquinas a través de una interfaz gráfica fácil de usar. Esta interfaz muestra datos completos, lo que simplifica la interacción y el funcionamiento.
Control de procesos por lotes: ISA88
ISA88 ofrece un valioso conjunto de directrices para el diseño y el funcionamiento de sistemas de control por lotes. Hace hincapié en características del proceso como la estandarización, la modularidad, la flexibilidad, la eficacia y la reducción de errores. Además, garantiza la trazabilidad, que es crucial para el cumplimiento de la normativa y el mantenimiento de una pista de auditoría completa.
Categorías de sistemas SCADA
Los sistemas SCADA pueden configurarse de forma diferente en función de cómo se instalen los elementos de hardware y software. Por lo tanto, diferenciamos entre DCS (sistema de control distribuido), SCADA remoto/cliente o SCADA en la nube:
- DCS (Sistema de Control Distribuido)
- SCADA remoto: Utiliza un modelo cliente/servidor con PLC remotos que se conectan a centros de procesamiento de datos.
- SCADA en la nube: Conecta los PLC a los servicios en la nube, centralizando el software necesario y las funciones de la base de datos.
Infraestructura DCS
Estos tipos de sistemas se basan en combinaciones de circuitos de control. Dentro de estos circuitos, varios PLC (controladores lógicos programables) están conectados a los sensores y equipos que controlan, los cuales, a su vez, están conectados a servidores y estaciones de trabajo (PC de control).
Una ventaja clave de los DCS (Sistemas de Control Distribuido) desde sus inicios es la capacidad de gestionar todas las señales del proceso de forma centralizada.
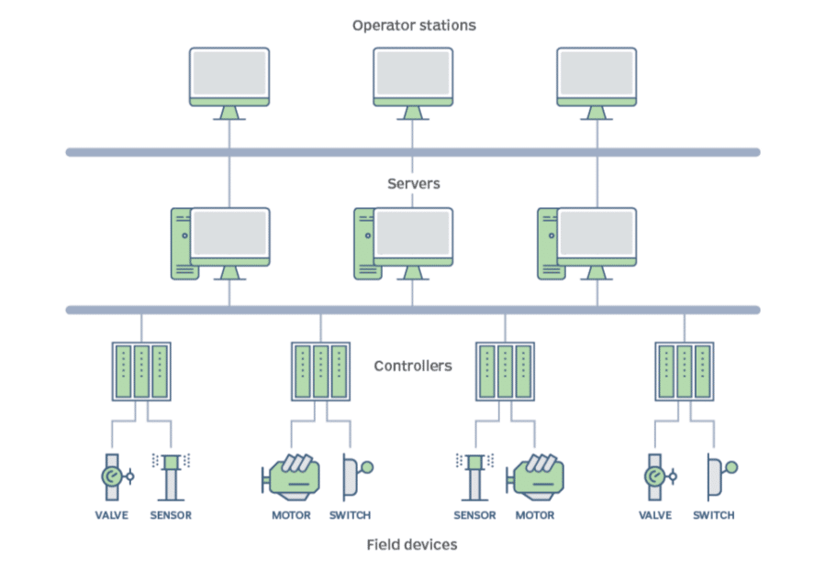
Fig. 1 Diagrama esquemático de las instalaciones DCS
SCADA remoto
En un sistema de control remoto SCADA cliente/servidor, la arquitectura es similar a la descrita anteriormente.
En esta configuración, los PLC que controlan la recepción de señales están conectados remotamente a servidores en un centro de procesamiento de datos (CPD), donde transfieren la información.
Posteriormente, los PC cliente pueden conectarse a los servidores SCADA para supervisar y controlar los PLC a través de ellos.
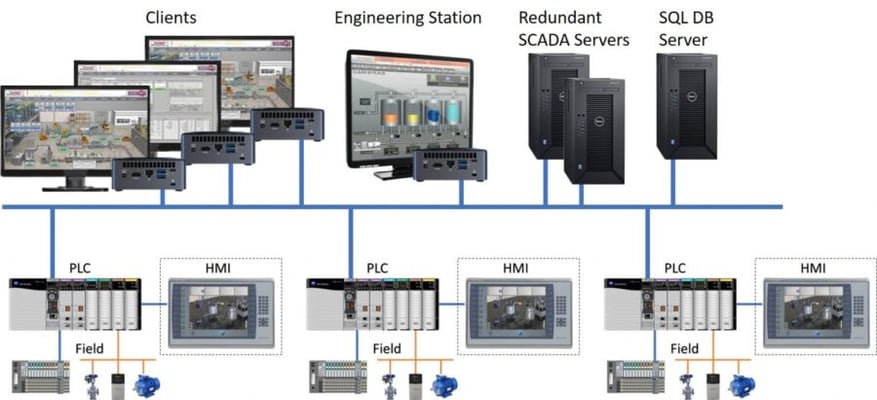
Fig. 2 SCADA remoto/clientes
SCADA en la nube
La infraestructura de este sistema SCADA se caracteriza por la integración de varios PLC con un servicio en la nube. Este servicio funciona a la vez como base de datos y como concentrador de software centralizado, lo que permite a los operadores conectarse al sistema y realizar las operaciones necesarias.
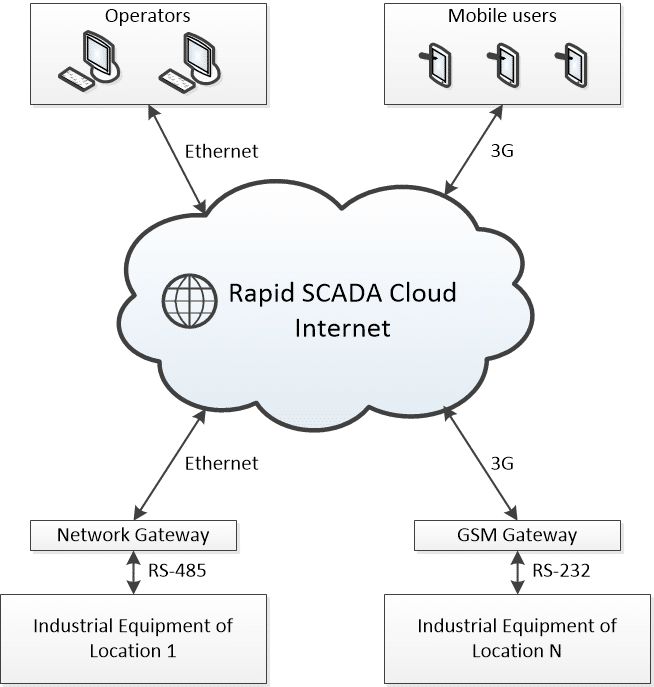
Fig. 3 Esquema de una infraestructura SCADA en la nube (SCADA Cloud)
Características de un sistema SCADA
Para un control óptimo del proceso y unos errores mínimos, un sistema SCADA debe poseer características esenciales como la gestión remota, capacidades de automatización, alarmas de incidentes, funcionalidades de transmisión de datos y controles de acceso seguros.
1. Gestión remota
Como se mencionó anteriormente, la gestión remota permite centralizar la recepción, gestión y control de la señal, simplificando así el proceso.
2. Automatización
El sistema debe permitir la automatización de tareas, como la gestión de lotes y la creación de recetas, como se ha comentado anteriormente. Esto no solo facilita el control del sistema, sino que también puede minimizar el riesgo de errores o incidentes.
3. Alarmas de incidentes
- uno inicial para alertar cuando los valores se acercan a un umbral
- y una segunda para cuando se supere este umbral.
4. Capacidad de recibir y enviar datos
Un sistema SCADA no solo debe recopilar información de sensores y equipos, sino también ser capaz de procesarla y permitir a los operadores enviar órdenes y comandos para modular la actividad del equipo.
5. Acceso y seguridad
Al igual que cualquier otro sistema computarizado, un sistema SCADA debe permitir que cada usuario ejecute sus funciones sin acceder o interferir con flujos de trabajo fuera de su función.
Validación de los sistemas SCADA
Normativa y directrices aplicables
Como cualquier otro sistema de la industria farmacéutica, los sistemas SCADA están sujetos a normas de validación muy estrictas. Estas normativas, definidas por entidades gubernamentales como la EMA, la FDA, la MHRA y otras, proporcionan un marco que debe cumplirse estrictamente para operar legalmente.
Para complementar estas normativas, existen organizaciones no gubernamentales que ofrecen información y directrices adicionales. Aunque no se consideran obligatorias, constituyen directrices de buenas prácticas y normas de calidad que, si se siguen, facilitan el cumplimiento de los requisitos reglamentarios. Ejemplos de estas organizaciones son ISPE, ISO, ICH, entre otras.
Un sistema SCADA consiste en un sistema automatizado e informatizado y los componentes de hardware asociados, que pueden estar directa o indirectamente relacionados con la industria farmacéutica. El siguiente cuadro resume, de forma no exhaustiva, las principales directrices de un sistema SCADA:
|
Norma
|
Directrices
|
|---|---|
|
ISO
|
Familia ISO 9000: Control de calidad y sistema de gestión de calidad
Familia ISO 2700: Gestión de la seguridad de la información ISO/IEC 12207:2017 - Systems and software engineering - Software life cycle processes (Ingeniería de sistemas y software - Procesos del ciclo de vida del software) |
|
ASTM
|
Norma ASTM E2500-20: Guía estándar para la especificación, diseño y verificación de sistemas y equipos de fabricación farmacéutica y biofarmacéutica
|
|
ICH
|
ICH - Directrices de calidad: Q8 (Desarrollo farmacéutico) Q9 (Gestión de riesgos), Q10 (EQ farmacéutica)
|
|
PICS/S
|
PI 011-3 Buenas Prácticas para Sistemas Informatizados en Entornos Regulados "GxP" (2007)
PI 041-1 Buenas prácticas para la gestión e integridad de datos en entornos "GMP/GDP" regulados |
|
ISPE
|
GAMP 5: A Risk-based Approach to Compliant GxP Computerized Systems- 2ª Edición (2022)
|
|
ISA
|
ISA18: Gestión de alarmas
ISA88: Control de procesos por lotes ISA101: Interfaz hombre-máquina ISA112: Sistemas SCADA |
Enfoque de validación SCADA
Un enfoque de validación interesante para un sistema SCADA es el "Enfoque del ciclo de vida" definido por GAMP5. Este enfoque, ilustrado en la Figura 4, proporciona un marco para la validación a lo largo de toda la vida útil del sistema:
- Antes de la implantación del sistema, se establece la definición del proyecto junto con los requisitos y especificaciones del sistema.
- La validación inicial permite liberar el sistema en el entorno operativo.
- Las modificaciones y actualizaciones se implementan a lo largo del ciclo de vida del sistema SCADA mediante la gestión del control de cambios.
- El sistema llega al final de su vida útil y se da de baja.
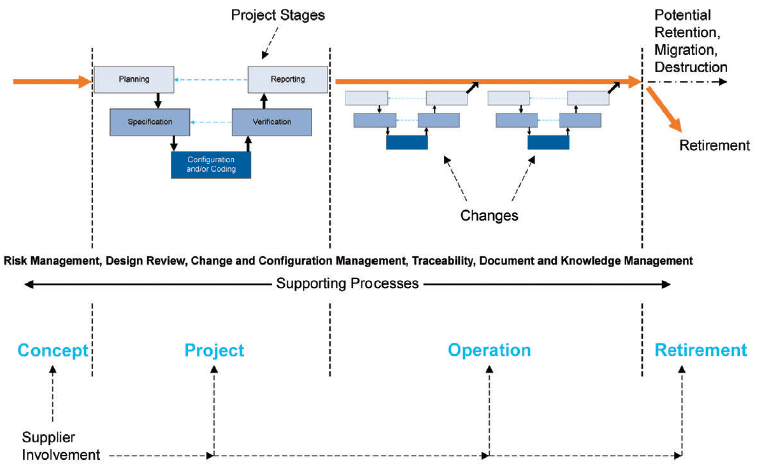
Fig. 4 GAMP5 'A Risk-Based Approach to Compliant GxP Computerized Systems', Segunda Edición, 2022, Etapas del Proyecto y Procesos de Apoyo dentro del Ciclo de Vida
Junto con el enfoque anterior, otro método recomendado por GAMP5 es el "modelo V", ampliamente utilizado en la validación de sistemas informatizados dentro de la industria farmacéutica.
Este método esboza la secuencia de actividades implicadas en el proceso de validación del software en función de su complejidad, centrándose en la relación entre las pruebas realizadas y los requisitos del software con sus especificaciones asociadas (véase la Figura 5).
Esta metodología se aplica tanto en la validación inicial como en la implementación de cambios a lo largo del ciclo de vida, aunque en este último caso se reduce su complejidad.
Es importante señalar que este no es el único modelo de validación disponible; por ejemplo, también puede utilizarse el modelo Agile. No obstante, utilizaremos el modelo V para ilustrar un caso de validación de un sistema SCADA.
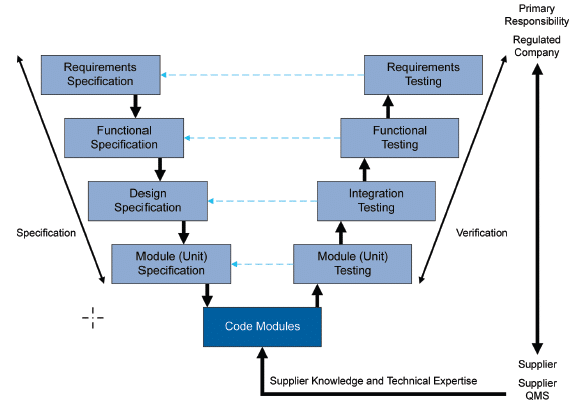
Fig. 5 GAMP5 'A Risk-Based Approach to Compliant GxP Computerized Systems', Segunda Edición, 2022, Enfoque para una aplicación personalizada (Categoría 5)
Visión general de la validación
Aunque cada proceso de validación de un sistema SCADA es diferente y está sujeto a las particularidades de cada caso, existen ciertas generalidades que pueden aplicarse a la gran mayoría de las situaciones.
Documentación requerida
Como se ha explicado en apartados anteriores de este post, es necesario tener documentadas las Especificaciones de Requisitos de Usuario (URS) y las Especificaciones del Sistema (FS, DS...).
Junto con la definición de requisitos y especificaciones, también es importante analizar y definir los riesgos asociados al proceso. Los objetivos del Análisis de Riesgos (AR) son múltiples:
- Establecer qué riesgos están asociados a los requisitos de usuario y rastrearlos hasta las especificaciones técnicas que definirán las características y/o funcionalidades del sistema.
- Evaluar los riesgos detectados en función de criterios objetivos.
- Establecer las condiciones y la metodología para mitigar los riesgos detectados hasta niveles aceptables.
Todo ello debe incluirse en un plan de validación del sistema SCADA. Además, los usuarios deben tener acceso a suficientes manuales de usuario, instrucciones y procedimientos normalizados de trabajo (PNT) para poder ejecutar sus respectivas funciones.
Características a validar
En cuanto a la validación de un sistema SCADA informatizado, podemos clasificar el proceso de validación en función de si afecta al hardware, al software o al proceso regulado:
Validación del hardware
Verificación de la instalación de hardware: Asegurar la correcta instalación de los diferentes componentes de hardware (hardware de control, equipos de campo...) según la documentación técnica.
Validación del software
- Verificación de la instalación del software: Asegurar la correcta instalación del software SCADA de acuerdo con la documentación técnica.
- Verificación de permisos de usuario: Asegúrese de que los diferentes roles de los usuarios dentro del sistema SCADA se hayan establecido correctamente y que limiten efectivamente los permisos dentro del programa.
- Verificación de la configuración de parámetros: Asegurar que el sistema permite la correcta gestión de los parámetros de los diferentes equipos asociados.
- Verificación de informes: Asegúrese de que el sistema pueda crear informes correctamente con las lecturas y datos asociados.
- Verificación de firma electrónica: Asegúrese de que todos los procesos aplicables se rastreen sin ambigüedades hasta el originador y que haya un flujo de firma electrónica implementado correctamente.
- Verificación de acceso: asegurar que el sistema limita adecuadamente a los usuarios no autorizados.
- Verificación de Audit Trail: Asegurar que el Audit Trail del sistema SCADA permita acceder al registro de acciones realizadas en el sistema, cumpliendo con los estándares de integridad de datos (ALCOA+).
Validación del proceso
- Verificación de señales: Asegurar que las señales, ya sean digitales o analógicas, procesadas en el sistema SCADA estén debidamente identificadas, haciendo que las lecturas sean trazables.
- Verificación de alarmas: asegúrese de que las alarmas funcionen correctamente y solo puedan configurarse por los usuarios con el rol adecuado.
- Verificación de seguridad: Asegurar que el sistema implementa correctamente las medidas de seguridad necesarias frente a posibles incidentes imprevistos.
- Verificación de recetas: Asegurar que el sistema permita la correcta creación y ejecución de recetas a partir de software por lotes.
- Verificación de extremo a extremo: asegúrese de que el flujo de trabajo funcione correctamente de principio a fin.
Una validación SCADA puede ser tan compleja como imprescindible para garantizar el correcto control de los procesos en la industria farmacéutica. Requiere verificar que todos los elementos que lo componen funcionan correctamente.
¿Necesitas ayuda para preparar la documentación de tu proceso de validación, o durante la ejecución de los protocolos? ¿O prefieres que un experto te apoye durante todo el proceso? Nuestros expertos en SCADA estarán encantados de ayudarte.






.png?width=109&height=108&name=Pharma%20(2).png)




.png)







