Servicios de representación en el país
Comprender el panorama normativo de los diagnósticos in vitro (IVD) y los dispositivos médicos (MD) en los mercados internacionales puede resultar complejo.
Cada país impone normas únicas, que a menudo requieren la designación de un representante autorizado para garantizar el cumplimiento local. Estas complejidades pueden crear barreras a la entrada en el mercado y a las ventas en curso, exigiendo un enfoque preciso y bien informado.
Descubre cómo nuestros servicios personalizados de representación en el país para IVD y MD pueden ayudarte a alcanzar el éxito en el mercado mundial.
Abre las puertas de los mercados europeo, británico y suizo
CLAVES PARA VENDER TU DISPOSITIVO EN EL EXTRANJERO
¿Necesitas servicios de representación para vender tus dispositivos médicos y/o IVD fuera de tu país?
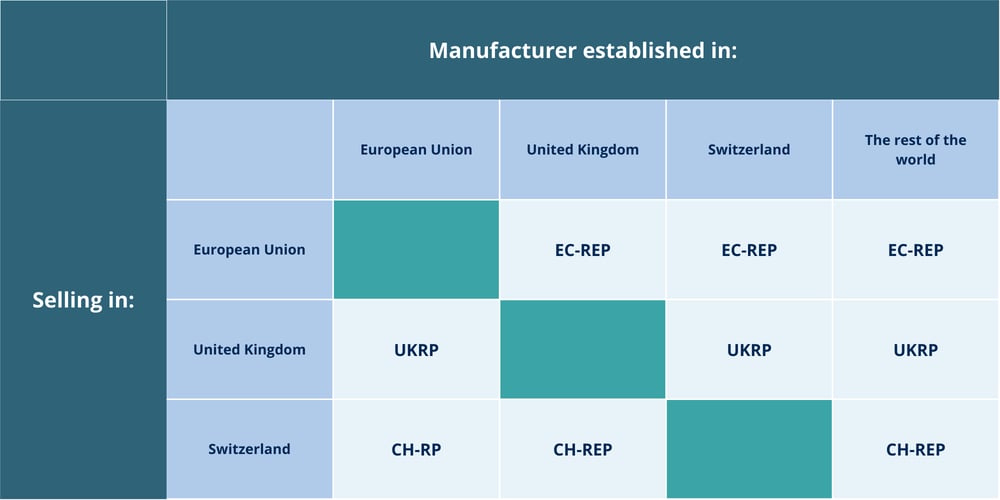
Qarad - parte de QbD Group - actúa como socio independiente capaz de actuar como tu Representante Autorizado (EC-REP), Representante Autorizado Suizo (CH-REP), o Persona Responsable del Reino Unido (UKRP).
¿Tienes dudas sobre la necesidad de servicios de representación para tus dispositivos médicos y/o IVD? Consulta nuestra descripción general a continuación.
¿Por qué QbD Group?
Durante muchos años, los especialistas de Qarad han servido como representantes autorizados europeos para más de 100 empresas distintas, apoyándose en la experiencia normativa y técnica del equipo. Podemos cubrir tus necesidades de servicios de representación actuando como:
.jpg?width=1080&height=1350&name=In-country%20representative%20service%20-%20Regulatory%20Affairs%20-%20QbD%20Group%20(1).jpg)
Contenidos relacionados



Contacta con nosotros
Ponte en contacto con nosotros para obtener más información o solicitar una propuesta gratuita y sin compromiso.






.png?width=109&height=108&name=Pharma%20(2).png)