
Whitepaper
.png?width=1600&height=900&name=Hero%20image%20(6).png)


.png)

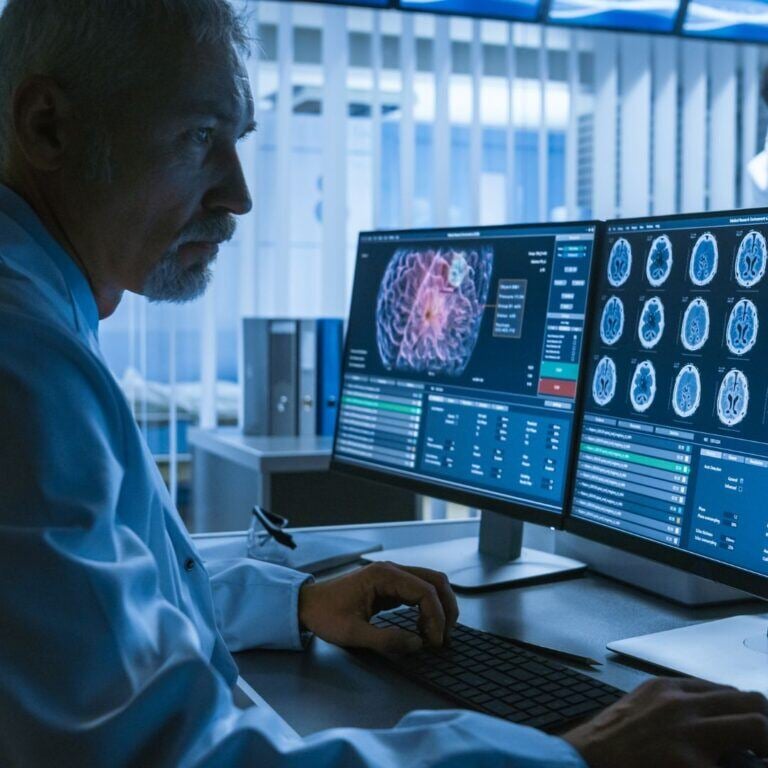


.jpg)
















 No Blog Post Found!
No Blog Post Found!

