La Agencia Reguladora de Medicamentos y Productos Sanitarios del Reino Unido (MHRA) lleva a cabo inspecciones de Buenas Prácticas de Farmacovigilancia (GPvP) desde 2003. Cualquier Titular de Autorización de Comercialización (TAC) o solicitante de autorización de comercialización está sujeto a una inspección GPvP para determinar su cumplimiento con los deberes necesarios de farmacovigilancia requeridos, con el fin de supervisar la seguridad de los medicamentos para el público en el Reino Unido (RU).
Las inspecciones suelen programarse por sistema de farmacovigilancia, producto o estudio de seguridad posterior a la autorización, en lugar de por titular de la autorización de comercialización. Para establecer la seguridad y el cumplimiento, debe existir un Sistema de Farmacovigilancia para cada titular de autorización de comercialización que describa en detalle las funciones y responsabilidades legales necesarias para demostrar la seguridad del medicamento autorizado, de acuerdo con cualquier cambio en la relación riesgo-beneficio del producto.
El Simposio GPvP de la MHRA se celebró el28 de febrero de 2024, donde se debatieron diversos temas para dar una idea de cómo la MHRA logra su objetivo de salvaguardar la salud del público.
En este blog, la atención se centra más en las métricas de inspección, para destacar las áreas clave en las que los PSM pueden seguir mejorando su sistema de GPvP y evitar esos hallazgos críticos, mayores o menores.
Tipos de inspecciones
El objetivo de las inspecciones rutinarias de FV es evaluar si el titular de la autorización de comercialización puede identificar, caracterizar y notificar riesgos nuevos o modificados asociados a sus medicamentos.
Las inspecciones rutinarias pueden ser iniciales o reinspecciones y se programan como parte del programa nacional de inspecciones de la MHRA de acuerdo con un enfoque basado en el riesgo, en línea con el Módulo III de Buena Farmacovigilancia (Good Pharmacovigilance, GVP). La MHRA avisará al titular de la autorización de comercialización antes de la inspección para que esté preparado.
En función de los resultados, el titular de la autorización de comercialización podrá ser objeto de una nueva inspección; de lo contrario, si no hay resultados críticos, no hay un plazo específico para que el titular de la autorización de comercialización deba ser inspeccionado de nuevo, y esto se determinará utilizando un enfoque basado en el riesgo.
Las inspecciones desencadenadas, también conocidas como "inspecciones por causa justificada", pueden programarse debido a información de inteligencia o a un hallazgo crítico previo. Esto incluye si la MHRA ha sido informada de información específica de riesgo en relación con el titular de la autorización de comercialización y sus productos autorizados. Las siguientes infracciones de la GPvP también requieren una inspección desencadenada:
-
un denunciante
-
otros departamentos de la MHRA
-
otra autoridad reguladora
Para este tipo de inspecciones se avisa con muy poca o ninguna antelación.
Métricas de inspección de GPvP de la MHRA para 2022/2023
Se realizaron 17 inspecciones de GPvP en 2022/2023, que incluyeron inspecciones rutinarias e inspecciones activadas .
Un número significativo de inspecciones realizadas durante este periodo fueron inspecciones "por causa - inteligencia". El siguiente gráfico muestra el desglose de las conclusiones emitidas por la MHRA junto con el tipo de inspección.

Fuente: Agencia Reguladora de Medicamentos y Productos Sanitarios
La mayoría de las conclusiones críticas se emitieron en las inspecciones iniciales rutinarias, seguidas de las reinspecciones rutinarias y las inspecciones "por causa - inteligencia". Los resultados mayores y menores de las inspecciones "por causa - críticas previas" son significativamente menores que los de otros tipos de inspecciones, lo que probablemente se deba al alcance limitado de este tipo de inspecciones.
Se requiere un Sistema de Gestión de la Calidad (SGC) sólido dentro de un sistema de farmacovigilancia para el TMA. Aunque el SGC no sea inspeccionado directamente por la MHRA, la mayoría de los hallazgos mayores y menores se encontraron en esta área debido a que el SGC sustenta los temas de FV circundantes. Se emitieron dos resultados críticos para la gestión de riesgos y uno para la evaluación continua de la seguridad , como se ilustra a continuación.

Fuente: Agencia Reguladora de Medicamentos y Productos Sanitarios
Durante el periodo de notificación de 2022/2023, se emitieron cuatro hallazgos críticos que se describen a continuación:
- Gestión de señales
- Mantenimiento de la información de seguridad de referencia (RSI)
- Medidas adicionales de minimización de riesgos (aRMM)
- Actividades adicionales de minimización de riesgos
El número de inspecciones del periodo de notificación anterior (2021/2022) se ha reducido de 32 a 17, sin embargo, el número medio de días de inspección se ha mantenido estable en torno a 9 días por inspección. Los siguientes temas siguen siendo los más importantes en términos de hallazgos durante las inspecciones:
- Gestión de riesgos
- Evaluación continua de la seguridad
- Sistema de gestión de la calidad
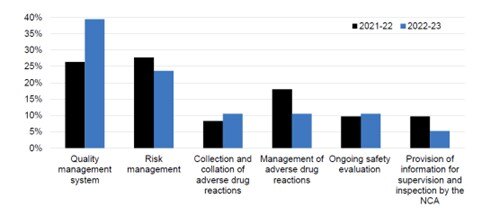
Fuente: Agencia Reguladora de Medicamentos y Productos Sanitarios
Evaluación piloto de la conformidad a distancia
En el equipo de GPvP se puso a prueba una evaluación remota del cumplimiento, que constituye un nuevo enfoque para el seguimiento de los resultados significativos de inspecciones anteriores. Normalmente, se realiza una nueva inspección tras un hallazgo importante o crítico para garantizar que las actividades de corrección se han implementado adecuadamente. Sin embargo, este nuevo enfoque sustituye a la necesidad de una reinspección completa, en circunstancias específicas.
RCA
- Hallazgo significativo en un tema principal
- Alcance limitado pero específico
- Siempre a distancia
- La revisión documental de la reparación es factible
Re-inspection
- Hallazgos significativos en múltiples temas
- La inspección a distancia no es factible
- Mayor alcance
- Las actividades de reparación son complejas o requieren entrevistas.
Dado que sólo habrá que considerar un tema concreto, no será necesario un plan de inspección completo, una presentación de la empresa ni entrevistas programadas de antemano. En su lugar, se elaborará un formulario de informe de ACR específico y se celebrará una breve reunión introductoria, y sólo se planteará un CAPA si el hallazgo es crítico o importante.
Conclusión
El equipo de GPvP de la MHRA sigue mejorando su proceso de realización de inspecciones para garantizar que sea rápido y rentable para todas las partes. Es crucial asegurarse de que existen las bases, como un SGC, para que un titular de autorización de comercialización establezca y mantenga las actividades de PV necesarias para un enfoque totalmente conforme y basado en el riesgo para los medicamentos.
Nuestro departamento de Vigilancia en QbD Group colaborará estrechamente con usted para comprender sus necesidades y objetivos empresariales y ofrecerle soluciones especializadas para ayudarle a alcanzarlos. Con nuestra orientación experta, podrá navegar con confianza por la normativa farmacéutica.






.png?width=109&height=108&name=Pharma%20(2).png)







.png)








