En los últimos años, cada vez se utilizan más medicamentos junto con un producto sanitario. Son los llamados " productos combinados". Ejemplos típicos de productos médicos combinados son los inhaladores precargados, las jeringuillas de insulina y los autoinyectores.
Estas combinaciones de fármacos y productos sanitarios dan lugar a tratamientos más eficaces y a nuevos enfoques para el tratamiento de enfermedades. Dejando a un lado los hechos positivos, se ha constatado que la información facilitada en las presentaciones en Europa es incoherente y a menudo incompleta porque la UE no dispone de una categoría para los productos combinados de medicamentos y productos sanitarios.
Por tanto, el producto combinado se define como medicamento o producto sanitario, en función del modo de acción primario. Si su producto resulta ser un medicamento, la vía reglamentaria seguirá siendo diferente para los distintos tipos de medicamento.
En este artículo, analizaremos la vía reglamentaria para introducir productos sanitarios combinados en el mercado europeo y compararemos la situación con la de Estados Unidos.
Elija su mercado: las diferencias entre los mercados de la UE y de EE.UU.
Lo primero que debe definir es en qué mercado desea lanzar su producto. Tanto en Europa como en Estados Unidos existen diferentes normativas y enfoques con respecto a los productos DDC.
El término "producto combinado" es, en contradicción con la normativa europea, definido por la Food and Drug Administration (FDA) en EE.UU.. Por consiguiente, la vía reglamentaria para introducir un producto combinado en el mercado es menos compleja en Estados Unidos, ya que una oficina específica, la Oficina de Productos Combinados (OCP ), supervisa la reglamentación de los productos combinados.
Si desea introducir su producto DDC en el mercado europeo, debe seguir los pasos que se describen en los siguientes capítulos.
Primer paso hacia el mercado: seguir la PMOA
La primera pregunta que debe surgir en su cabeza durante la búsqueda de la aprobación reglamentaria de su producto sanitario combinado en la UE es el modo primario de acción (PMOA). Este modo primario definirá los reglamentos que debe seguir. ¿La acción de su sustancia medicinal es auxiliar? En caso afirmativo, su producto está regulado como producto sanitario conforme al MDR 2017/645. En caso de que la acción de su producto combinado sea principalmente de la sustancia medicinal, el producto se regulará como medicamento.

Figura 1- Diagrama de flujo: Definición del PMOA y legislación(es) correspondiente(s)
Vía reglamentaria para los productos combinados de productos sanitarios
Si su producto combinado se define como un producto sanitario, de acuerdo con la tabla anterior, debe ajustarse a los requisitos generales de seguridad y funcionamiento (RGS ) enumerados en el anexo I del MDR 2017/745 de la UE y debe obtener un marcado CE por parte de un organismo notificado (ON).
No es necesario consultar a la Agencia Europea de Medicamentos (EMA) para el producto en sí, solo el medicamento auxiliar, si está presente en el producto, debe ser aprobado por la EMA. Este es el caso de los stents liberadores de fármacos, un catéter con revestimiento antimicrobiano, etc.
El organismo notificado debe solicitar el dictamen científico de la EMA sobre la calidad, seguridad y utilidad de la sustancia medicinal accesoria en tres casos:
- si la sustancia auxiliar se deriva de sangre o plasma humanos;
- si ha sido evaluada previamente por la EMA
- si entra en el ámbito obligatorio del procedimiento centralizado.
Para otras sustancias, el organismo notificado puede solicitar el dictamen de una autoridad nacional competente o de la EMA, por ejemplo, en los casos en que la EMA ya haya evaluado un medicamento que contenga la misma sustancia medicinal.
Vía reglamentaria para los medicamentos combinados
Si su producto combinado se define como medicamento, hay diferentes pasos que debe seguir para lanzar su producto al mercado europeo...
La EMA evalúa la seguridad y eficacia de los medicamentos utilizados en combinación con un producto sanitario.
Diferentes tipos de medicamentos
Las directrices de la EMA y el MDR describen diferentes tipos de productos combinados, ya que la normativa difiere (ligeramente) para cada tipo:
-
Integral: el MP y el MD forman un único producto integrado, por ejemplo, un inhalador precargado.
-
Envasado conjuntamente: el MP y el MD son objetos separados incluidos en el mismo envase, p. ej., inhalador y cartucho que contiene el medicamento.
-
Referenciado: el fabricante del medicamento hace referencia a un producto sanitario específico que se utilizará junto con el producto MD, pero que se vende por separado. p. ej., aerocámara

Figura 2 - Ejemplo de diferentes tipos de productos combinados de medicamentos y dispositivos (DDC)
Medicamento integral/envasado conjunto: ¡el camino hacia el mercado!
Cuando tu producto combinado se define como medicamento, debes seguir diferentes normativas en función del tipo.
El siguiente diagrama de flujo describe el proceso que debe seguirse para obtener todos los documentos y certificados de calidad necesarios. Se basa en la directriz sobre documentación de calidad para medicamentos cuando se utilizan con un producto sanitario.
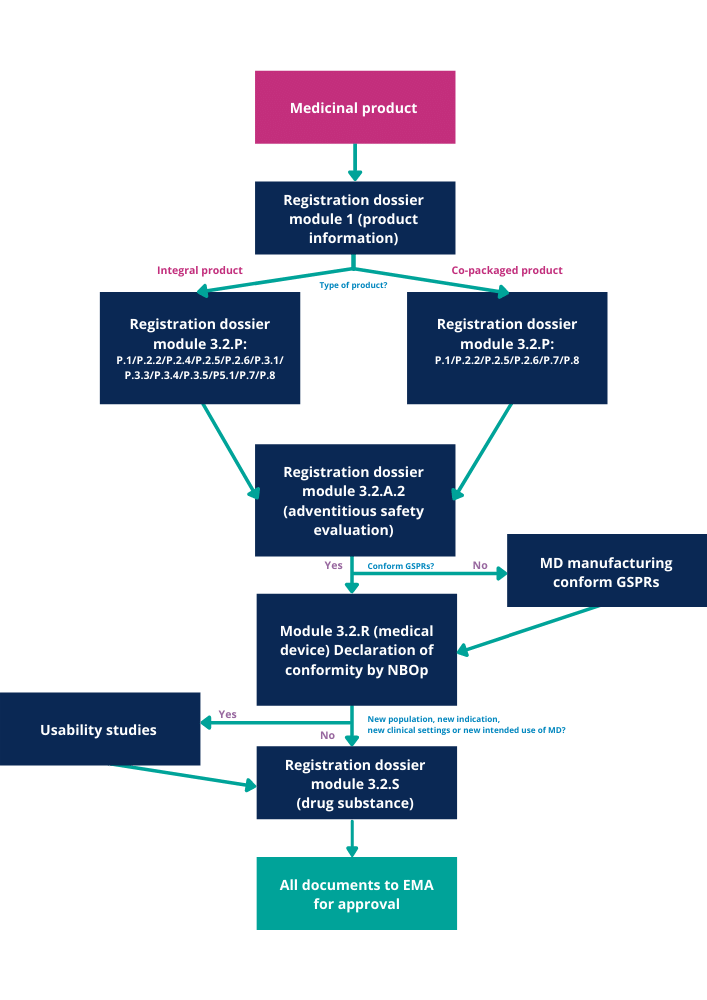
Figura 3 - Diagrama de flujo de los documentos de calidad de los medicamentos DDC
A continuación encontrarás un breve resumen del contenido de estos módulos. Para más información, consulta las directrices de la EMA o póngase en contacto con el Grupo QbD para obtener más asesoramiento.
Módulo 1 - Información de producto
- La información del producto debe cumplir los requisitos del Reglamento (CE) n.o 726/2004 o de la Directiva 2001/83/CE, según proceda, y no debe incluir ninguna información administrativa sobre el producto (pieza).
- La información sobre el producto (parte) necesaria para el uso previsto del medicamento debe incluirse en las secciones correspondientes del prospecto y en el resumen de las características del producto (SmPC).
Módulo 3.2.P - Módulo 3.2.P - Producto farmacéutico
- Descripción y composición
- Desarrollo farmacéutico – Fabricantes
- Control de productos farmacéuticos*
- Sistema de cierre de contenedores (CCS)*
- Estabilidad
Módulo 3.2.A.2 - Evaluación de la seguridad adventicia
- Deberán identificarse todos los materiales de origen humano o animal utilizados en el proceso de fabricación del medicamento. Se debe proporcionar una evaluación de riesgos sobre la posible contaminación con estos materiales.
Módulo 3.2.R - Producto sanitarios
- La conformidad del producto (pieza) con los SGPR pertinentes (anexo I del Reglamento (UE) 2017/745) debe incluirse de conformidad con el artículo 117 del MDR, sin el requisito de estar regulado como un producto con marcado CE. Los fabricantes deben solicitar un dictamen de un organismo notificado (NbOp) para esta confirmación. Los productos integrales clasificados como productos de clase I (es decir, no estériles) no están sujetos a un dictamen NB.
- Los estudios de usabilidad deben incluirse si:
-
- La información de apoyo no se incluye en el expediente, y el producto (parte) no se ha utilizado en la población de usuarios prevista antes o
- Otros aspectos del uso previsto son nuevos o diferentes del uso previsto, tal y como confirma el certificado de la UE emitido por un NB o NBOp.
Módulo 3.2.S - Sustancia farmacéutica
- Es aceptable la referencia a un Archivo Maestro de Principios Activos o a un Certificado de Idoneidad de la Dirección Europea para la Calidad de los Medicamentos. Debe seguirse el procedimiento descrito en la "Directriz sobre el procedimiento del archivo maestro de sustancias activas" y la "Directriz sobre el resumen de los requisitos para las sustancias activas en la parte de calidad del expediente".
- Una parte muy importante de los productos DDC es que debe demostrar que la parte de la sustancia farmacéutica del producto no afecta al dispositivo médico. Cuando se incluya más de una sustancia farmacéutica en el producto combinado, debe incluir el módulo 3.2.S para cada sustancia farmacéutica.
Hacer referencia a un producto sanitario en su producto: diferentes requisitos reglamentarios a tener en cuenta
Cuando se hace referencia a un producto sanitario en la información del producto de la DDC, puede ser necesaria información adicional del producto sanitario, ya que el producto al que se hace referencia puede tener un impacto potencial en la calidad, seguridad y/o eficacia.
La información sólo es necesaria si el producto al que se hace referencia no forma parte de un grupo de productos (por ejemplo, jeringuillas, líneas de infusión, etc.). En este caso, debe proporcionar los siguientes documentos antes de obtener la aprobación de la EMA:
- El impacto del producto de referencia sobre el producto sanitario debe considerarse utilizando un enfoque basado en el riesgo, teniendo en cuenta la necesidad de un estudio de usabilidad.
- El módulo 1 debe presentarse igual que para los productos combinados integrales y coenvasados.
- Deberán incluirse pruebas de seguridad y/o bioequivalencia/eficacia del medicamento utilizado con el producto sanitario.
- El módulo 3.2.P.2 debe representar los datos sobre compatibilidad, precisión de la dosificación, funcionalidad, manejo, manipulación, etc.
- La estabilidad durante el uso, si procede, debe representarse en el módulo 3.2.P.8.
- La información sobre usabilidad debe representarse por las mismas razones que para los productos integrales y coenvasados.
Compatibilidad: una buena relación entre el medicamento y el producto
La evaluación de la compatibilidad de un producto con determinados medicamentos es crucial, ya que el paciente interactúa frecuentemente con el medicamento y el producto. La compatibilidad de ambos componentes requiere el análisis de distintos aspectos, como la estabilidad del fármaco, la compatibilidad química y la biocompatibilidad. Todos los aspectos deben estar en equilibrio para establecer una buena coherencia de los productos combinados y evitar cualquier peligro para el paciente.
Conclusión: defina la vía reglamentaria para sus productos sanitarios combinados
Conozca las diferentes vías de regulación y tenga en cuenta los pasos que se indican a continuación antes de introducir en el mercado productos combinados de productos sanitarios (DDC).
- Elija su mercado, por ejemplo, UE o EE.UU.
- Defina el modo de acción primario
- En el caso de un medicamento: ¡defina su tipo!
¿Necesitas ayuda con la regulación y documentación de tus productos sanitarios combinados? No dude en ponerse en contacto con nosotros. Nuestros expertos estarán encantados de ayudarte.
- Guía QWP-BWP sobre medicamentos utilizados con un producto sanitario (europa.eu)
- Productos sanitarios | Agencia Europea de Medicamentos (europa.eu)
- Preguntas y respuestas para solicitantes, titulares de autorizaciones de comercialización de medicamentos y organismos notificados con respecto a la aplicación de los Reglamentos sobre productos sanitarios y productos sanitarios para diagnóstico in vitro ((UE) 2017/745 y (UE) 2017/746) (europa.eu)
- Artículo 117 del MDR: Una nueva implicación para los productos combinados de fármaco y dispositivo (celegence.com)






.png?width=109&height=108&name=Pharma%20(2).png)





.png)








