En los últimos años, los medicamentos destinados al mercado europeo se fabrican cada vez más fuera de la UE. Aunque esta tendencia es especialmente notable en la producción de principios activos, también es cada vez más frecuente en la fabricación de medicamentos acabados.
Al mismo tiempo, la globalización ha hecho más complejas las cadenas de suministro de productos farmacéuticos. Para garantizar la supervisión, la UE clasifica a los importadores de medicamentos como fabricantes, exigiéndoles que obtengan una Autorización de Importación de Fabricación (MIA) y cumplan la normativa sobre Buenas Prácticas de Fabricación (GMP).
Este marco exige la implantación de un sistema de calidad farmacéutica, personal e instalaciones adecuados, gestión de reclamaciones y retiradas, y un estricto control de la cadena de suministro.
En esta guía, exploraremos los aspectos clave del GMP Anexo 21, sus implicaciones para los importadores de medicamentos y las mejores prácticas para garantizar su cumplimiento.
GMP Anexo 21: visión general
El anexo 21 de las GMP establece los requisitos de las GMP para los titulares de MIA que importan medicamentos de fuera de la UE/EEE. El anexo se aplica a
- los medicamentos de uso humano
- medicamentos veterinarios
- los medicamentos en investigación
Sin embargo, no cubre los productos sin autorización de comercialización de la UE/EEE que se reexportan directamente.
Definición de "importación" con arreglo al GMP Anexo 21
El anexo ofrece una interpretación común de importación, definiéndola como la introducción física de un medicamento procedente de fuera de la UE/EEE.
La importación es un proceso regulado, y la liberación de lotes por parte de una Persona Cualificada (QP) sólo puede tener lugar tras la importación física y el despacho de aduanas dentro de un estado de la UE/EEE.
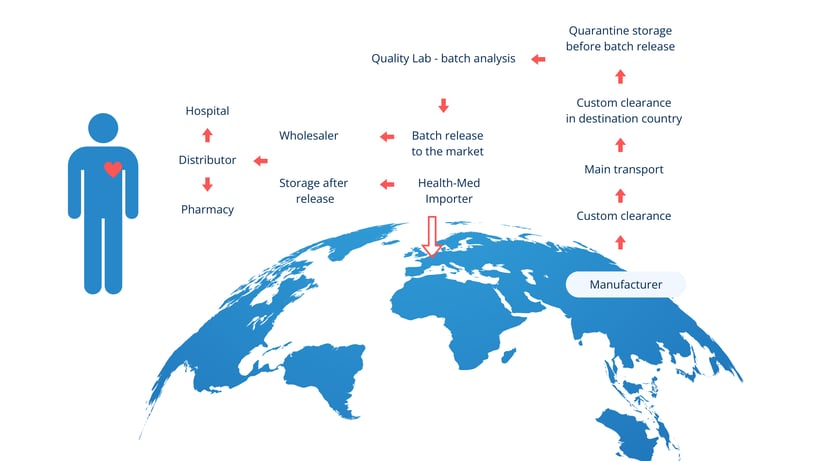
Lugares clave en el proceso de importación
El anexo 21 de las buenas prácticas de fabricación destaca dos lugares críticos que intervienen en la importación de medicamentos:
- Lugar de importación física: el lugar donde el medicamento entra por primera vez en la UE.
- Lugar de certificación de la QP: donde una persona cualificada (QP) realiza la certificación del lote antes de la liberación.
Estos lugares deben considerarse en el contexto más amplio de toda la cadena de suministro, en la que también participan
-
Fabricantes de API
-
Fabricantes de medicamentos de terceros países
-
Empresas de transporte
-
Instalaciones de pruebas de control de calidad para productos importados
-
Titulares de autorizaciones de comercialización (TAC)
Requisitos de conformidad para los importadores
En el caso de los medicamentos importados de países sin Acuerdo de Reconocimiento Mutuo (MRA), la legislación de la UE exige la realización de pruebas por lotes en el momento de la importación, antes de la certificación de la garantía de calidad y de la liberación, de conformidad con el anexo 16 sobre prácticas correctas de fabricación.
El lugar de las pruebas y los requisitos mínimos de las mismas se describen en:
- la letra b) del apartado 1 del artículo 51 de la Directiva 2001/83/CE (para los medicamentos de uso humano)
- Artículo 55(1)(b) de la Directiva 2001/82/CE (para medicamentos veterinarios).
Referencia a las orientacionesde Eudralex
El anexo 21 de BPF hace referencia a otros capítulos y anexos de Eudralex, en particular al anexo 16, que ya define las responsabilidades de una persona cualificada (PC) para la certificación y liberación de lotes.
Sin embargo, el Anexo 21 enfatiza aún más el papel del Titular de la Autorización de Comercialización (TAC) para garantizar el cumplimiento de las BPF durante todo el proceso de importación y fabricación.
Por ejemplo:
- El MAH debe asegurarse de que los QP tengan pleno acceso a la documentación del lote en todo momento.
- El titular de la autorización tiene la responsabilidad última de la comercialización de los medicamentos y debe tener acuerdos por escrito con todos los centros pertinentes.
Revisión de la calidad del producto (PQR) en la importación
El Anexo 21 también aclara los requisitos de la Revisión de la Calidad del Producto (PQR) para los productos importados. La QP certificadora debe:
- Comparar los resultados analíticos del centro de pruebas de importación con el certificado de análisis del fabricante del tercer país.
- Garantizar la existencia de un programa de estabilidad permanente, incluso si las pruebas se realizan en un tercer país, siempre que la QP tenga acceso a los datos de estabilidad.
Conclusión
A medida que la fabricación de productos farmacéuticos y las cadenas de suministro siguen globalizándose, el GMP Anexo 21 desempeña un papel crucial a la hora de garantizar la supervisión regulatoria de los medicamentos importados.
El anexo refuerza el marco para los titulares de MIA, haciendo hincapié en las responsabilidades de las QP, la integridad de la cadena de suministro y un riguroso control de calidad.
Las empresas que importan medicamentos a la UE deben anticiparse a los requisitos de cumplimiento, garantizar una documentación sólida y establecer colaboraciones sólidas en toda la cadena de suministro.
¿Necesita ayuda para cumplir las GMP en la importación de medicamentos?
En QbD Group ofrecemos servicios integrales a las empresas que importan medicamentos a la UE. Nuestro laboratorio con certificación GMP y nuestros servicios de persona cualificada (QP) garantizan la liberación de lotes sin problemas, el cumplimiento de la normativa y unos procesos de importación eficientes.
Simplificamos tu acceso al mercado de la UE. Ponte en contacto con nuestros expertos hoy mismo.






.png?width=109&height=108&name=Pharma%20(2).png)







.png)





