Servicios para Companion Diagnostics
¿Qué son los Companion Diagnostics?
HACIA EL ACCESO REGULATORIO Y COMERCIAL
En la UE, el Companion Diagnostic (CDx) se define como un dispositivo esencial para el uso seguro y eficaz de un medicamento correspondiente.
Están diseñados para identificar a los pacientes que tienen más probabilidades de beneficiarse de ese medicamento antes o durante el tratamiento o para identificar a los pacientes que pueden correr un mayor riesgo de experimentar efectos secundarios graves como consecuencia de ese medicamento.
Con la entrada en vigor del Reglamento sobre dispositivos médico para diagnóstico in vitro (IVDR) en la UE, los companion diagnostics están ahora sujetos a nuevos requisitos normativos que tienen un impacto significativo en su desarrollo y comercialización.
Dado que lo ideal es que los CDx se desarrollen conjuntamente con los fabricantes de productos farmacéuticos, la unión de estos dos marcos normativos distintos plantea retos únicos.
Entendemos las complejidades normativas que implica el diseño y el desarrollo de los companion diagnostics, así como el desarrollo de la medicina personalizada, por lo que contamos con equipos especializados en regulación con experiencia en IVD y medicamentos que pueden trabajar juntos para respaldar tus esfuerzos de desarrollo conjunto.
Esto nos permite superar los retos que conlleva la introducción de diagnósticos complementarios en el mercado, garantizando el cumplimiento de la normativa y el éxito comercial.
¿Qué son los Companion Diagnostics?
HACIA EL ACCESO REGULATORIO Y COMERCIAL
En la UE, el Companion Diagnostic (CDx) se define como un dispositivo esencial para el uso seguro y eficaz de un medicamento correspondiente.
Están diseñados para identificar a los pacientes que tienen más probabilidades de beneficiarse de ese medicamento antes o durante el tratamiento o para identificar a los pacientes que pueden correr un mayor riesgo de experimentar efectos secundarios graves como consecuencia de ese medicamento.
Con la entrada en vigor del Reglamento sobre dispositivos médico para diagnóstico in vitro (IVDR) en la UE, los companion diagnostics están ahora sujetos a nuevos requisitos normativos que tienen un impacto significativo en su desarrollo y comercialización.
Dado que lo ideal es que los CDx se desarrollen conjuntamente con los fabricantes de productos farmacéuticos, la unión de estos dos marcos normativos distintos plantea retos únicos.
Entendemos las complejidades normativas que implica el diseño y el desarrollo de los companion diagnostics, así como el desarrollo de la medicina personalizada, por lo que contamos con equipos especializados en regulación con experiencia en IVD y medicamentos que pueden trabajar juntos para respaldar tus esfuerzos de desarrollo conjunto.
Esto nos permite superar los retos que conlleva la introducción de diagnósticos complementarios en el mercado, garantizando el cumplimiento de la normativa y el éxito comercial.
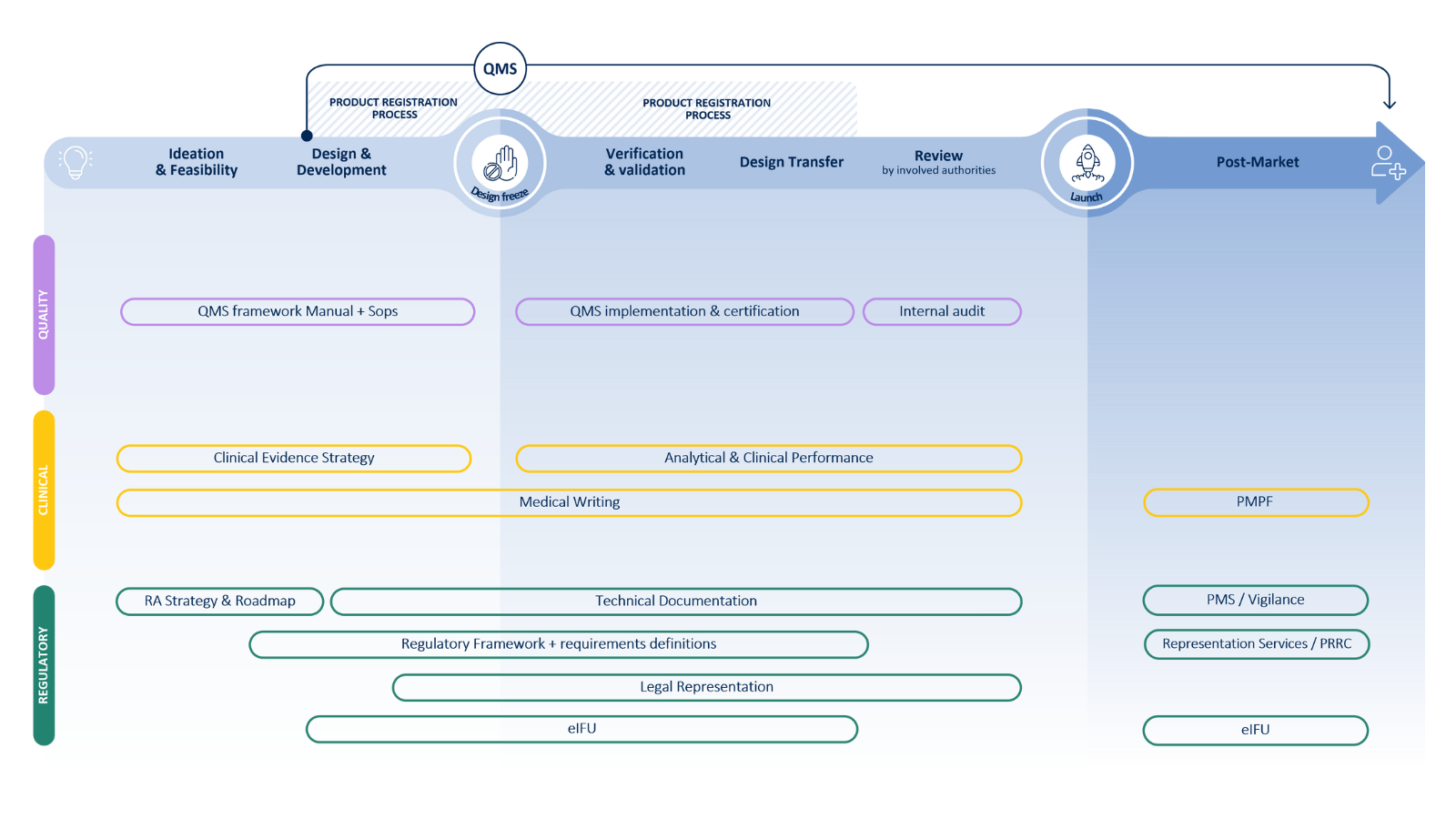
Nuestros servicios de Companion Diagnostics (CDx)
Dispositivo
Medicamento

Dispositivo
Nuestros servicios de desarrollo de dispositivos abarcan la orientación estratégica, la gestión de proyectos y el apoyo integral en todas las fases del desarrollo de CDx:
-
Compromiso con organismos notificados: Asistencia en la selección, contratación y colaboración con organismos notificados.
-
Apoyo en la presentación y revisión: Guiándote a través del proceso de presentación y revisión de su CDx con el organismo notificado.
-
Implantación del sistema de gestión de la calidad: Te ayudamos a implantar un sistema de gestión de la calidad (QMS) que cumpla las normas.
-
Diseño e implementación de estudios de rendimiento clínico: Asistencia en el diseño e implementación de tus solicitudes de estudios de rendimiento clínico en la UE, según el Anexo XIV.
-
Representación legal: Actuar como tu representante legal para las solicitudes de estudios del rendimiento clínico conforme al artículo 58(4) del IVDR.
-
Redacción médica y paquete de presentación: Revisión o redacción de tu paquete de presentación, junto con la oferta de información detallada sobre la compleja estrategia de presentación en los Estados miembros de la UE.
-
Estrategia de acceso al mercado: Asistencia en el desarrollo de una estrategia de acceso al mercado que abarque los requisitos regulatorios y de reembolso en diversas zonas geográficas.
-
Evaluaciones económicas de la salud y participación de los pagadores: Proporcionar orientación sobre evaluaciones económicas de la salud, fijación de precios, negociaciones de reembolso y compromiso con los pagadores.
-
Representación autorizada: Actuar como tu representante autorizado para la UE, el Reino Unido y Suiza en virtud del artículo 2(25) del IVDR.
-
Formación en IVDR y CDx: Formación in situ o a distancia sobre aspectos generales o específicos del IVDR y los requisitos normativos para el uso de un CDx en desarrollo en ensayos clínicos en la UE, el Reino Unido y Suiza.

Medicamento
La experiencia de QbD Group se extiende al aspecto del producto medicinal del desarrollo del Companion Diagnostic, donde proporcionamos servicios que incluyen:
-
Colaboración con organismos notificados: Asistencia en la selección, contratación y colaboración con organismos notificados.
-
Apoyo en la presentación y revisión: Te guiamos en el proceso de presentación y revisión de tu CDx ante el organismo notificado.
-
Solicitud de autorización de comercialización: Asistencia en la presentación y revisión de solicitudes de autorización de comercialización de medicamentos.
-
Implantación de sistemas de gestión de la calidad: Ayudarte a implantar un sistema de gestión de la calidad (QMS) que cumpla las normas.
-
Solicitudes de ensayos clínicos: Ayudar con la presentación y el mantenimiento de las solicitudes de ensayos clínicos en virtud del Reglamento de Ensayos Clínicos (UE) 536/2014 (CTR) en la UE, y el Reglamento de Medicamentos de Uso Humano (Ensayos Clínicos) en el Reino Unido.
-
Redacción médica: Revisión, redacción y publicación de todos los módulos eCTD necesarios para obtener la autorización de comercialización.
-
Estrategia de acceso al mercado: Asistencia en el desarrollo de una estrategia de acceso al mercado que abarque los requisitos regulatorios y de reembolso en diversas zonas geográficas.
-
Evaluaciones económicas de la salud y participación de los pagadores: Orientación sobre evaluaciones económicas de la salud, fijación de precios, negociaciones de reembolso y colaboración con los pagadores.
-
Formación sobre requisitos normativos: Formación presencial y a distancia sobre los requisitos normativos para realizar ensayos clínicos con medicamentos en la UE y el Reino Unido.
¿Por qué QbD Group?
Nuestro equipo ofrece un conocimiento inigualable en diagnóstico de compañía, guiándole de forma eficiente a través de cada fase de desarrollo.
- Perspectivas estratégicas para una ventaja competitiva
Adelántate a tus competidores con nuestros servicios de consultoría estratégica, diseñados para satisfacer las exigencias del sector. - Enlace entre fabricantes de IVD y patrocinadores farmacéuticos:
Acortamos distancias entre los fabricantes de IVD y los patrocinadores farmacéuticos, garantizando el cumplimiento sincronizado de la normativa y el avance puntual de los proyectos. - Soluciones integrales para el desarrollo de fármacos y dispositivos:
Desde el desarrollo inicial hasta el lanzamiento al mercado, nuestros expertos ofrecen soluciones integrales tanto para fármacos como para dispositivos, garantizando el avance fluido de los proyectos en cada fase.
.jpg?width=1600&height=900&name=Companion%20Diagnostics%20Services%20-%20QbD%20Group%20(2).jpg)







.png?width=109&height=108&name=Pharma%20(2).png)