Normas sobre gases comprimidos
El último borrador del Anexo 1, Fabricación de Medicamentos Estériles, introdujo el concepto de«estrategia de control de la contaminación» que limita la contaminación por partículas y microbios y promueve la comprensión del proceso, lo que significa:
- Un conocimiento profundo de las posibles fuentes de contaminación.
- Se realiza un análisis periódico de las tendencias, garantizando los atributos de calidad críticos adecuados de los servicios públicos de alto riesgo.
- Los gases y otras utilidades de alto riesgo que entran en contacto directo con el producto o el contenedor primario tienen una calidad química, de partículas y microbiana adecuada .
En concreto, deben tomarse medidas para garantizar la esterilidad de los gases de proceso, incluida la filtración a través de un filtro esterilizador en el punto en el que el gas se utiliza en la producción, y la esterilización de cualquier tubería o conducto posterior.
La filtración debe formar parte de las normas de los lotes, con una certificación garantizada antes de la liberación. Las pruebas de integridad deben realizarse tanto para los filtros de gas críticos como para los no críticos.
«Cuando se utilizan gases en el proceso, se debe realizar un control microbiano del gas periódicamente en el punto de uso».
Aunque en las GMP de la UE y la FDA se hace referencia al muestreo de aire comprimido, la norma ISO 8573 establece el enfoque general y los requisitos para los gases comprimidos. La norma ISO consta de las siguientes partes:
- Parte 1: Contaminantes y clases de pureza,
- Parte 2: Métodos de ensayo para el contenido de aceite en aerosol,
- Parte 3: Métodos de ensayo para la medición de la humedad,
- Parte 4: Métodos de ensayo para el contenido de partículas sólidas,
- Parte 5: Métodos de ensayo para el contenido de vapores de aceite y disolventes orgánicos,
- Parte 6: Métodos de ensayo para el contenido de contaminantes gaseosos,
- Parte 7: Método de ensayo del contenido de contaminantes microbiológicos viables,
- Parte 8: Métodos de ensayo para el contenido de partículas sólidas por concentración de masa,
- Parte 9: Métodos de ensayo del contenido de agua líquida.
La norma ISO 8573-1 incluye las clases de pureza y un principio de designación. Las partes 2 a 9 proporcionan información valiosa para la parte interesada o el laboratorio de análisis, e incluyen técnicas analíticas y métodos de muestreo.
Las clases de pureza se ajustan a lo que está disponible comercialmente para eliminar estos contaminantes principales.
El cuadro resumen (Figura 1) que aparece a continuación muestra las clases de pureza de 0 a X para las partículas, el agua y el aceite. El usuario final puede entonces seleccionar una clase de pureza para cada contaminante en función del equipo instalado o de la calidad del aire requerida para un proceso o producto específico.
No debería haber ninguna confusión sobre los contaminantes y los límites que deben analizarse, ya que esa decisión se tomó cuando se seleccionaron los filtros del sistema de compresores y los filtros del punto de uso.
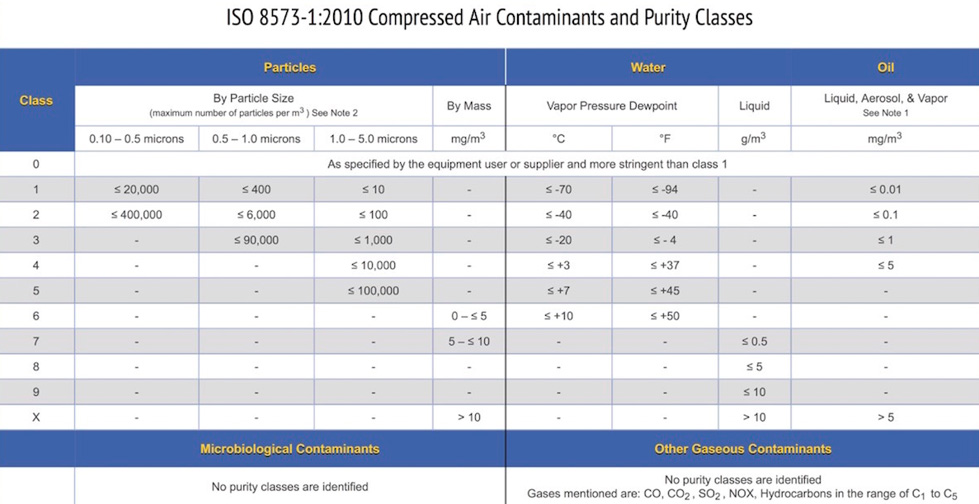
Figura 1 – ISO 8573-1:2010 Contaminantes del aire comprimido y clases de pureza
Obsérvese que la norma ISO 8573-7, método de prueba del contenido de contaminantes microbiológicos viables, no especifica la frecuencia ni los límites de los contaminantes microbiológicos viables.
La frecuencia y los límites deben basarse en una evaluación del riesgo de las actividades y deben ser lo suficientemente frecuentes como para permitir la evaluación de tendencias significativas.
Las cifras microbianas aceptables se basan en una interpretación de las GMP, como el documento de la FDA Aseptic Filling Guidance (2004), que establece:
«Un gas comprimido debe tener la pureza adecuada (por ejemplo, sin aceite) y su calidad microbiológica y de partículas tras la filtración debe ser igual o mejor que la del aire del entorno en el que se introduce el gas».
Contaminantes microbiológicos en los gases comprimidos
Los sistemas de gas comprimido y aire son entornos relativamente duros, sin embargo, la supervivencia de los microbios es posible, si hay nutrientes disponibles.
Los nutrientes aptos para ser metabolizados por los microorganismos incluyen agua y gotas de aceite. Otro factor que puede afectar a la supervivencia es la temperatura.
Además de las células vegetativas, las esporas bacterianas están bien equipadas para sobrevivir a las duras condiciones ambientales. Las esporas son resistentes a los tipos de rangos de temperatura y niveles de humedad que se encuentran dentro de las líneas de gas comprimido.
Existe otro riesgo con el biofilm, donde las comunidades microbianas pueden formarse y desarrollarse a través de la adhesión a las líneas y tubos de aire.
Normalmente no se espera que se recuperen microorganismos de las líneas de gas comprimido. La fuente más frecuente es la contaminación adventicia.
Las fuentes de contaminación incluyen:
- Fuente del aire de gas. En el caso del aire, se trata de la entrada de aire del entorno (que puede contener aceite, suciedad/polvo y humedad/vapor de agua, microorganismos).
- Sistemas de distribución de tuberías. Las tuberías de distribución y los tanques de almacenamiento de aire, más frecuentes en los sistemas antiguos, tendrán contaminantes en forma de óxido, incrustaciones en las tuberías y depósitos minerales, además de bacterias.
- Filtro retenedor de bacterias. El filtro puede bloquearse, perder su integridad o mojarse.
- Fallo del compresor. El propio compresor puede crear una contaminación Por ejemplo, los prefiltros del compresor pueden sobrecargarse de polvo y pelusas, haciendo que el filtro deje de funcionar correctamente.
- Válvula de muestra. Es posible que la válvula de muestreo del punto de uso no esté diseñada correctamente o que esté defectuosa.
Plan de vigilancia microbiana de los gases comprimidos
El análisis de los datos de microcarga en las salidas de los puntos de uso a lo largo de los sistemas de tuberías de aire comprimido en un momento dado, actúa como una ventana de observación en el control de la instalación.
Mantener el control significa que el mantenimiento preventivo, la programación de la vigilancia microbiana y la evaluación de riesgos deben ser apropiados para la industria que se vigila.
Una vez aprobado el plan de control microbiano del aire comprimido, es necesario establecer un procedimiento de muestreo que proporcione a la empresa los resultados adecuados a sus límites y especificaciones.
Esto requiere el uso de un procedimiento que mida y tome muestras de un volumen específico de aire para el análisis de la carga microbiana dentro del sistema de aire comprimido probado.
El muestreo de aire comprimido debe formar parte de un programa de control ambiental, junto con las evaluaciones de la sala limpia.
El programa debe tener en cuenta los puntos de aire que se van a probar. Puede tratarse de cada punto, de puntos considerados de mayor riesgo (como el contacto con el producto) o de puntos representativos a lo largo de un bucle.
También hay que tener en cuenta la frecuencia de las pruebas, y esto
también tendría que vincularse al riesgo.
¿Por qué utilizar un laboratorio contratado?
La inversión en el equipo adecuado puede ser costosa, no sólo por el coste del equipo analítico, sino también por la capacidad de preparación, la infraestructura como los gases y la extracción, así como la formación de los analistas y la cualificación de la instrumentación.
El uso de un laboratorio de análisis por contrato acreditado suele ser una forma muy eficaz de realizar validaciones y análisis elementales de rutina. Los beneficios incluyen
- Velocidad de análisis
- Conocimiento
- Visión clara de los costes por adelantado
Quercus, su laboratorio GMP de confianza
Quercus Laboratories es miembro del grupo QbD y es un laboratorio GMP de confianza que apoya a la industria farmacéutica con una amplia gama de servicios de pruebas de control de calidad. Ofrecemos un servicio completo de pruebas de control de calidad químico y microbiológico de materias primas y productos farmacéuticos acabados.
Nuestras capacidades incluyen:
Validación de métodos analíticos – Liberación de lotes – Servicios de importación a la UE – Análisis rutinario de control de calidad de lotes – Pruebas de materias primas – Pruebas microbiológicas – Pruebas de eficacia de conservantes – Estudios de estabilidad y almacenamiento – Validación de salas limpias – Muestreo de aire activo – Control de gases comprimidos – Pruebas de impurezas elementales – Pruebas de endotoxinas – Análisis de agua purificada (COT) – Validación de limpieza
Póngase en contacto con nosotros.
Referencias
- USP 1116 – Evaluación microbiológica de salas limpias y otros entornos controlados
- ISO 8573 – Aire comprimido
- UE GMP – Anexo 1: Fabricación de medicamentos estériles
- ICH Q9 Gestión de riesgos de calidad
