El grupo de calificación y validación dentro de QbD organizó su primera
Centro de Competencia
hace unas semanas. Este foro se utiliza para debatir temas interesantes relacionados con la cualificación y la validación en general. Como tema principal para 2019, hemos seleccionado la validación de procesos como punto central. En tres sesiones, repartidas a lo largo de 2019, se diseccionará y analizará a fondo el tema. Durante este primer centro de competencia profundizamos en los principios generales del tema. A continuación se ofrece un pequeño resumen de los temas tratados.
Para empezar, nos remitimos a varias directrices que cubren este tema, como la ICH8 R2, el anexo 15 y la“Validación de procesos: principios y prácticas generales” de la FDA. En todas las directrices se recomienda el “enfoque del ciclo de vida”, en el que la “calidad por diseño” es una herramienta adecuada aplicada a la validación de procesos. En el anexo 15 se distingue además entre la validación tradicional y la continua del proceso.
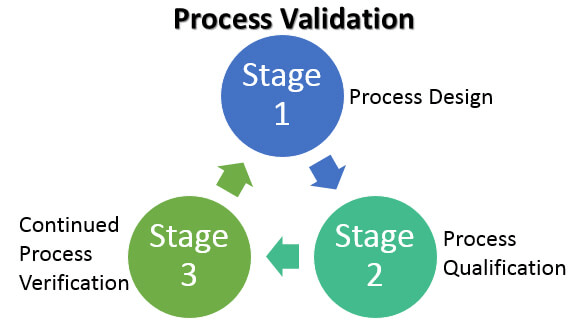
En general, en la validación del proceso se distinguen tres etapas distintas:
Etapa 1 – Diseño del proceso
Un buen proceso “robusto” comienza con el diseño del proceso a través de los CQA basados en el QTPP de un producto.
¿Qué son los QTPP? QTPP son las siglas en inglés de Quality Target Product Profile (perfil de producto objetivo de calidad ) y significa un resumen prospectivo de las características de calidad de un medicamento que idealmente se alcanzarán para garantizar la calidad deseada, teniendo en cuenta la seguridad y la eficacia. Ejemplos de ello son la vía de administración, la forma de dosificación, la biodisponibilidad, la potencia, la estabilidad, …
A partir de los QTPP se pueden definir una serie de CQA potenciales. CQA significa Atributo Crítico de Calidad y es una propiedad o característica física, química, biológica o microbiológica que debe estar dentro de un límite, rango o distribución adecuados para garantizar la calidad deseada del producto. Las CQA se determinan a través de la Evaluación de Riesgos. La evaluación de riesgos es un valioso proceso de base científica utilizado en la gestión de riesgos de calidad que puede ayudar a identificar qué atributos de los materiales y parámetros del proceso tienen potencialmente un efecto sobre las CQA del producto.
Es importante definir el espacio de diseño, que consiste en una combinación e interacción multidimensional de todos los parámetros del proceso y su efecto sobre las CQA. El espacio de diseño se desarrollará normalmente a escala de laboratorio o piloto y puede dividirse a su vez en diferentes límites restringidos, a saber, EOF (Edge Of Failure), PAR (Proven Acceptance Range) y NOR (Normal Operating Range).
El EOF se define como el punto en el espacio de diseño en el que los lotes individuales, los lotes o los viales no cumplirán los criterios de aceptación del lote. El EOF puede determinarse experimentalmente explorando el espacio de diseño hasta encontrar fallos y simulando el espacio de diseño extrapolado aunque no se hayan detectado fallos experimentalmente.
El PAR se considera como el rango de parámetros caracterizado para el que se verifica que el proceso dará lugar de forma consistente a un producto que cumple con sus especificaciones predeterminadas. El PAR puede establecerse mediante experimentos a escala de laboratorio de lotes de prueba a escala de producción y piloto.
El NOR del proceso se sitúa dentro del PAR para cada uno de los parámetros críticos del proceso. Su rango refleja la variación esperada del proceso y la capacidad de control del parámetro (del equipo). El NOR asegura que el producto se produce cumpliendo sus especificaciones predeterminadas.
Etapa 2 – Calificación del proceso
Durante la etapa de calificación del proceso (PQ ) de la validación del proceso, se evalúa el diseño del proceso para determinar si es capaz de una fabricación comercial reproducible.
Son CPP (Parámetros Críticos del Proceso) que tienen un impacto en los CQA’s que necesitan ser verificados durante la cualificación y serán utilizados en la cualificación continua del proceso para el control del mismo. Los CPP típicos son las velocidades de fresado, las velocidades de vórtice, la temperatura,…
En la validación tradicional se suele “validar” un solo parámetro dentro de los criterios de aceptación. Cuando se aplica un enfoque de “calidad por diseño”, se puede evaluar y definir la interacción entre las distintas PPC, lo que proporciona un mayor control y conocimiento del proceso dentro del espacio de diseño.
Además, en la validación tradicional, el sagrado número 3, es decir, 3 ejecuciones consecutivas durante la calificación, no es aplicable en un enfoque de QbD como tal. Hay que definir cuántas ejecuciones se necesitan para cubrir todas las variaciones de los PCC que tienen un impacto crítico en los CQA. Así que puede seguir siendo 3 pero también más o incluso menos. Se necesita una justificación sólida y ésta se basa en la evaluación de riesgos.
Vale la pena mencionar que existe una distinción entre la denominación de este proceso entre las directrices de la UE y las de la FDA. En las directrices de la UE se utiliza la denominación “cualificación del proceso”. La contrapartida en las directrices de la FDA es la “calificación del rendimiento del proceso”. Esto podría dar lugar a confusión, ya que en las directrices de la UE la cualificación del rendimiento se utiliza normalmente como último paso de la cualificación de los equipos.
Etapa 3 – Verificación continua del proceso
Durante esta etapa se realiza un seguimiento continuo del proceso de producción a través de los PCC’s identificados, la evaluación de estos datos asegura un estado de control. La evaluación de los datos recogidos durante el proceso de producción se utiliza para identificar desviaciones no deseadas de los PPC definidos durante la cualificación. Esta información puede utilizarse, por ejemplo, para identificar tendencias, que pueden servir para evaluar si es necesario tomar medidas correctivas o preventivas. Esto permite un control mucho más directo del proceso, ya que las desviaciones se pueden detectar durante el propio proceso de producción y se pueden tomar medidas inmediatas.