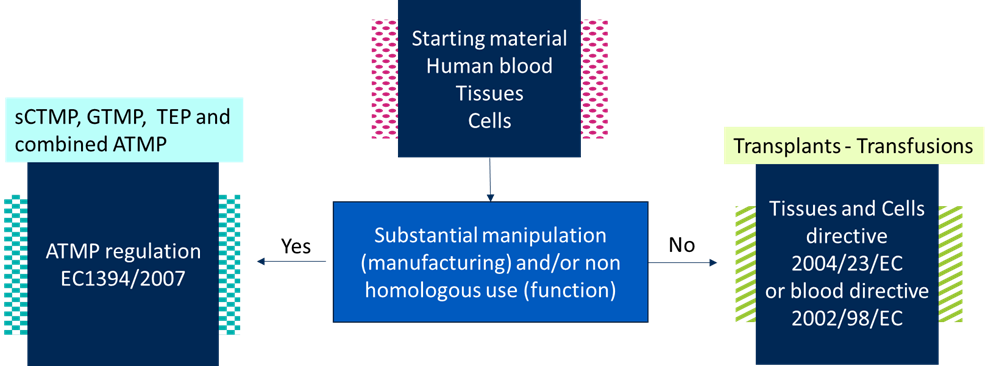
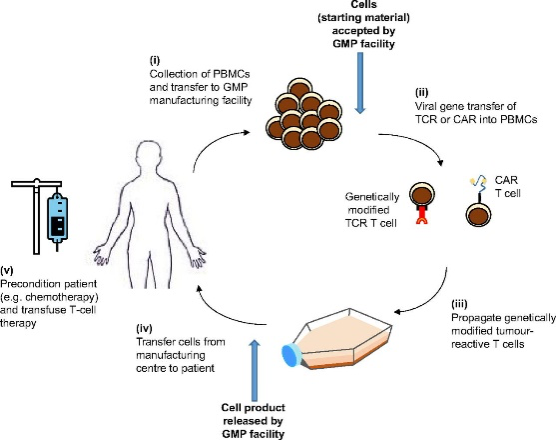
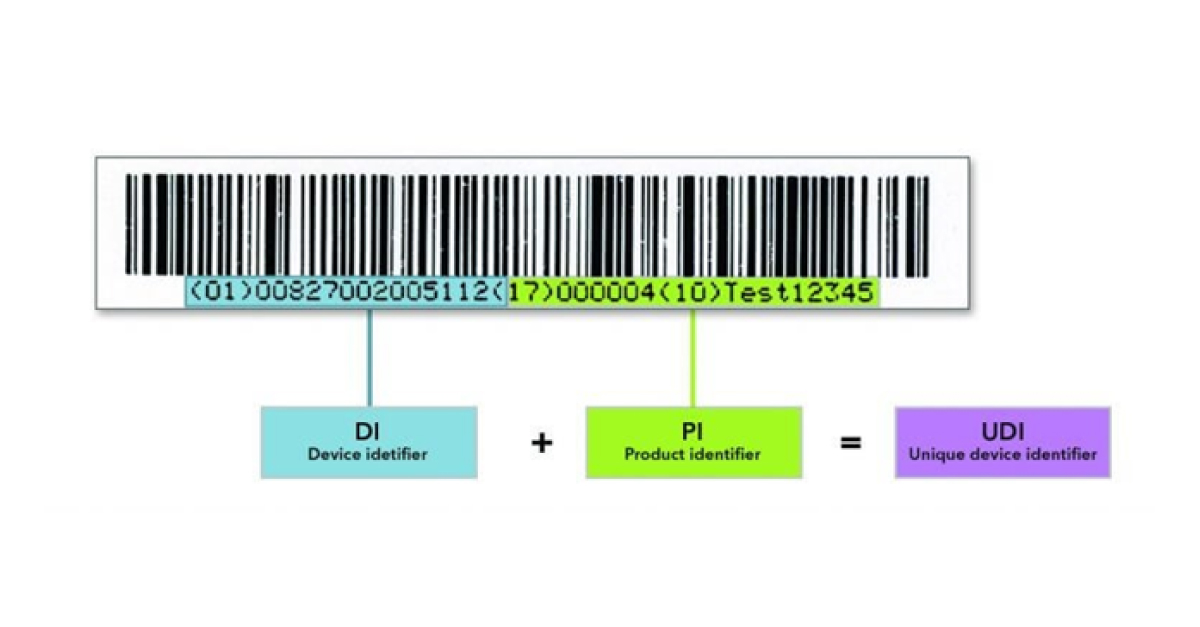
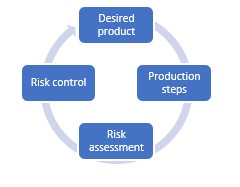
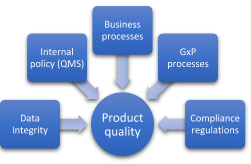
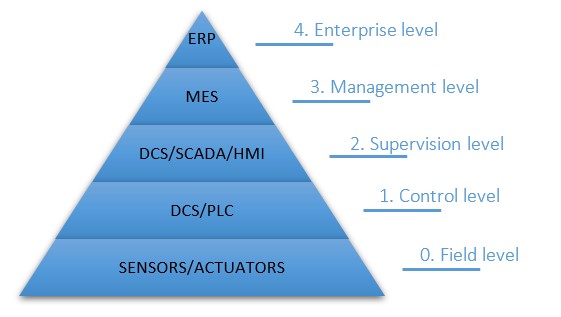
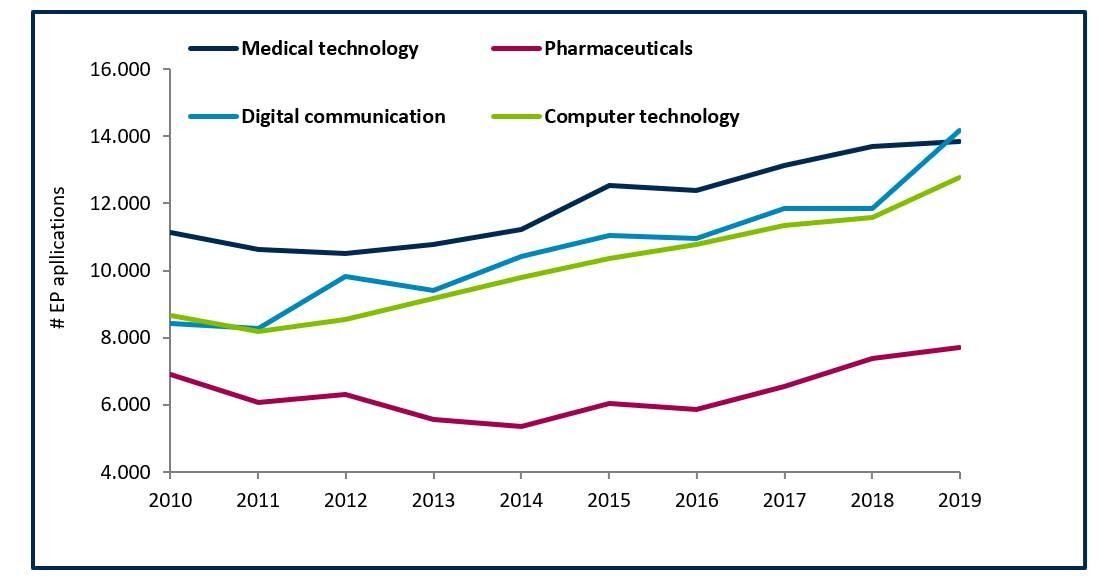
La impresión 3D permite crear dispositivos médicos específicos para el paciente para mejorar la calidad de la asistencia
La impresión 3D ofrece una flexibilidad y una personalización inigualables en los dispositivos médicos, como ilustra el caso del trasplante de cara y mano de Joe DiMeo. ¿Tienes curiosidad? No deje de leer.