Procesos GxP
Sin duda, el impacto de los procesos de GxP, como la calidad de los productos y la salud de los pacientes, ocupan el primer lugar de la lista cuando se trata de evaluar los riesgos de un sistema informático. Estas son cruciales para decidir si se valida un sistema informático. Por lo tanto, la experiencia y el conocimiento del usuario final son de gran valor a la hora de ponderar los impactos.
A primera vista, los procesos empresariales no son importantes desde el punto de vista normativo. Sin embargo, es necesario evaluarlos si la empresa desea seguir generando valor a partir de los procesos. Una estrategia, por ejemplo, en la que los costes no cubran el mantenimiento del sistema o la validación necesaria, puede dar lugar a riesgos importantes que pongan en peligro el futuro de la empresa.
Otro ejemplo: un distribuidor de medicamentos no fabrica los productos y no realiza análisis para determinar la pureza e identidad de los mismos. La actividad principal del distribuidor es almacenar y entregar. Este sistema no afecta directamente a la seguridad del paciente. Sin embargo, puede afectar a la calidad del producto si la distribución no se realiza según las instrucciones del fabricante. Como consecuencia, la seguridad del paciente también puede estar en riesgo. Esto podría dar lugar a una violación de las GxP y de los requisitos empresariales. Muchos factores (in)directos pueden influir en la calidad de un producto y, por tanto, en la salud del paciente.
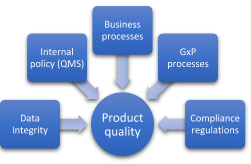
La política interna tiene una gran influencia en la calidad del producto a través del sistema de gestión de la calidad (SGC). Todo el personal debe conocer o participar en el SGC. Cuanto más repercuten en la calidad del producto, más deben implicarse. Piense en la informática, la dirección, los recursos humanos, el departamento de control de calidad, la producción, los proveedores, los distribuidores, etc. No aplicar las prácticas de GxP puede suponer una pérdida de credibilidad ante los clientes, demandas, cierre de la planta, multas, o lo que es peor: un impacto negativo en la salud de los pacientes.
Cuando una empresa no controla la formación y la cualificación del personal, esto significa que el personal no cualificado está operando el sistema. Esto aumenta la incertidumbre del sistema y, por lo tanto, conlleva mayores riesgos.
Cuando una empresa carece de controles y procedimientos para el uso, el archivo, la copia de seguridad, la restauración, la transmisión y la modificación de los datos, es probable que el proceso carezca de integridad de los datos. Por ejemplo, un empleado se encuentra con un error en un sistema mientras procesa un medicamento. El empleado no sigue el procedimiento estándar y pide a un empleado de TI que resuelva el problema rápidamente. Los datos se modifican a petición del interesado sin atenerse a los procedimientos. ¿El resultado? El riesgo de falta de integridad de los datos es importante.
En conclusión, la validación de un sistema informático implica muchas capas de procesos. Está inseparablemente entrelazada con el SGC. Los datos son un gran negocio.
Puedes leer más sobre la integridad de los datos en un blog anterior y volveremos a tratar el tema en uno de nuestros próximos blogs.
¿Cómo puede ayudarle la QbD?
QbD cuenta con diferentes expertos en validación de sistemas informáticos en su equipo. Si tiene alguna pregunta sobre los temas mencionados, no dude en ponerse en contacto con nosotros.
