En el campo de la medicina regenerativa, los medicamentos de terapia avanzada (ATMP) representan la próxima generación de medicamentos. Sin embargo, no es tan sencillo trasladar esta nueva experiencia a un proceso GMP. En este artículo, aprenderá más sobre los desafíos y los aspectos cruciales.
- medicamentos de terapia genética (MTG),
- medicamentos de terapia celular (CTMP),
- productos de ingeniería tisular (TEP),
- o una combinación de las anteriores.
Representan la opción terapéutica más prometedora, a veces única, para diversas enfermedades en las que la medicina tradicional ha demostrado ser ineficaz.
Una terapia basada en ATMPs se utiliza a menudo para el tratamiento de enfermedades raras. Por lo tanto, se dirige a una población específica de pacientes.
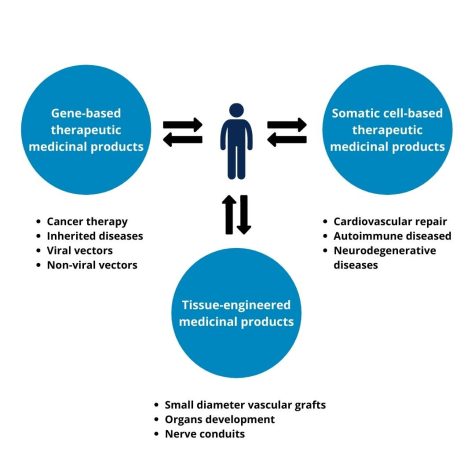
Figura 1 – Representación esquemática de los medicamentos terapéuticos avanzados. CAR: receptor de antígeno quimérico. Adaptado de Goula et al.
Preparación de los ATMP: cómo hacer frente a una reserva de productos heterogénea
El primer paso en el desarrollo de los ATMP es aislar las células o los tejidos de fuentes humanas. Esta es una de las razones por las que se considera que la fabricación de ATMP está estrictamente relacionada con el área clínica y de trasplantes. Tras la manipulación de la materia prima, los ATMP se preparan para su uso autólogo (mismo individuo) o alogénico (diferente donante).
- Manipuladas como células vivas, las CTMP se recogen mediante aféresis, se modifican, se expanden y se administran al paciente para tratar enfermedades o lesiones a nivel celular.
- Los GTMP consisten en ácido nucleico recombinante, destinado a la regulación de secuencias genéticas directamente en el paciente (in-vivo) o en sus celdas después de colección (ex–vivo).
- Las TEP se basan en el uso de poblaciones de células madre inmaduras (por ejemplo, células madre) o diferenciadas, con el fin de reparar los tejidos estructuralmente comprometidos del paciente.
Dada la naturaleza de los ATMP, representan un conjunto extremadamente heterogéneo de productos cuya preparación difiere sustancialmente de la fabricación de biofármacos convencionales. Por lo tanto,
- un alto grado de conocimientos técnicos,
- una sólida formación clínica,
- y procesos de producción muy especializados
son necesarios para el desarrollo de los ATMP. En consecuencia, la historia del desarrollo de los ATMP ha sido bastante accidentada hasta hace poco.
Del ATMP al GMP: una historia accidentada
Falta de legislación y escasa armonización
Durante mucho tiempo, la mayor contribución al desarrollo de los ATMP provino de hospitales, pequeñas empresas e instituciones académicas. Instalaciones que a menudo tienen recursos financieros restringidos y competencias limitadas para navegar por los procedimientos reglamentarios necesarios para abordar las normas industriales GMP.
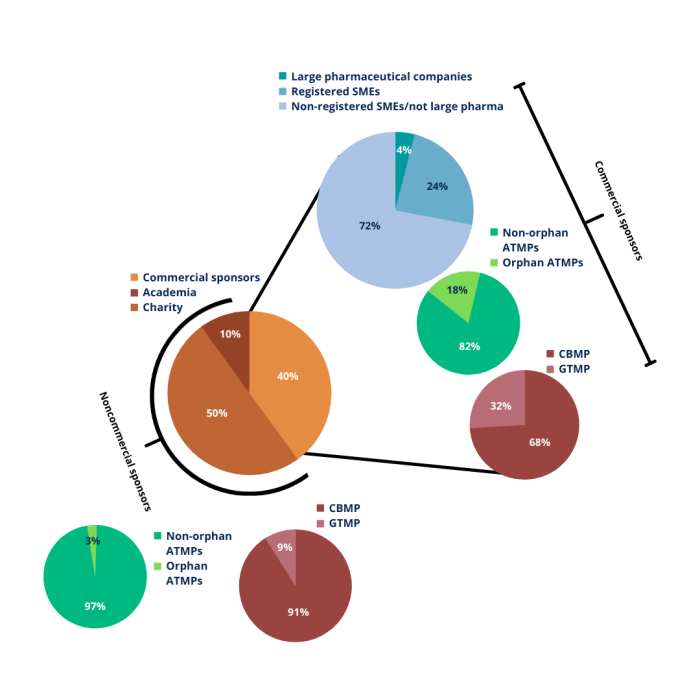
Figura 2 – El panorama de los medicamentos antirretrovirales en Europa 2004-2010. Adoptado de Maciulaitis et al
Durante años, la falta de un marco legislativo real caracterizó el desarrollo de los ATMP, lo que condujo a una variedad de entornos individuales de fabricación académica/hospitalaria.
Además, la escasa armonización en la aplicación de las prácticas correctas de fabricación en los Estados miembros de la UE, que estuvo en vigor hasta 2009, agravó el problema. Sin embargo, como productos farmacéuticos, los ATMP tienen que cumplir las normas de fabricación y calidad. Este es un asunto complicado cuando se traduce el desarrollo del ATMP en un proceso de GMP.
Difícil implementación y aplicación
La segunda crítica encontrada al transferir la fabricación de los ATMP a la Industria Farmacéutica se refiere a la aplicación de las mencionadas normas GMP: dadas las características únicas y la alta especificidad de los pacientes de los ATMP, las normas GMP comunes no pueden aplicarse sin más. Por lo tanto, a pesar de que el desarrollo de ATMPs juega un papel clave en el tratamiento de enfermedades raras o degenerativas, llevar estos productos médicos al mercado no es un proceso fácil.
El TAC y los procedimientos centralizados: un gran avance
En enero de 2009 se dio un gran paso en la regulación de los medicamentos de terapia avanzada, con la creación del Comité de Terapias Avanzadas (CAT), en la Agencia Europea del Medicamento (EMA).
Este comité científico multidisciplinar tiene como objetivo revisar la calidad, la seguridad y la eficacia de los ATMP de acuerdo con las normas establecidas por las autoridades reguladoras. Hoy en día, junto con la introducción de procedimientos centralizados para la fabricación de ATMP, el CAT ayuda a las empresas farmacéuticas a establecer la producción de ATMP. Haga clic aquí para saber más sobre los principales obstáculos de la comercialización de un ATMP.
Aspectos cruciales de la fabricación de ATMP en un entorno moderno de GMP
A pesar de la accidentada historia, el desarrollo de los ATMP es un proceso activo y continuo. Sin embargo, trasladar la fabricación de estos productos terapéuticos a un entorno GMP sigue planteando importantes retos.
La variabilidad intrínseca del material de partida, así como del producto terminado, requiere procedimientos de fabricación que necesariamente se desvían de los de los productos biológicos tradicionales.
La extrema diversidad del material de partida obtenido de un paciente se debe, entre otras cosas, a la edad, la salud y la enfermedad de esa persona. Esto requiere una identidad y un seguimiento impecables de los lotes. Además, las terapias ATMP requieren un diseño de ensayo complejo, ya que se dirige a una población de pacientes única. Por lo tanto, a diferencia de los biofármacos comunes, necesitamos procesos flexibles, bien supervisados y controlados para hacer frente a la complejidad de los ATMP.
A pesar de la introducción de procedimientos centralizados para la fabricación de ATMPs, los desarrolladores de ATMPs están pidiendo una orientación más específica con respecto a los requisitos de GMP que rigen el proceso de fabricación.
Transporte del paciente al lugar de la manipulación
Para empezar, uno de los primeros obstáculos para la producción de ATMP en condiciones GMP que se menciona en la literatura es el transporte de la muestra recogida desde el paciente hasta el lugar de la manipulación. El contexto del entorno intraoperativo escapa en cierto modo a la normativa de las BPF, lo que contradice la necesidad de evitar la contaminación. Una posible solución a este problema podría ser operar en un sistema cerrado, pero la propia definición de un entorno cerrado es controvertida.
Esterilidad del producto final
Otro caso en el que los productores de ATMP tienen que lidiar con la falta de requisitos unificados de GMP es el de la esterilidad. Al igual que con los CTMP, la presencia de células vivas enteras impide la filtración a través de filtros de grado de esterilización, por lo que el producto final no puede necesariamente ser esterilizado. Dado que no se puede realizar la esterilización final, la esterilidad del producto final debe garantizarse mediante pruebas rutinarias de esterilidad durante la fabricación a y simulaciones de procesos asépticos .
Logística relacionada con la fabricación de ATMPs
La logística asociada a la producción de ATMP también es muy crítica, ya que la estabilidad de la muestra humana y de los ATMP finales disminuye significativamente con la duración del transporte y depende estrictamente de la temperatura. Estos y otros muchos aspectos de la producción de medicamentos de uso tópico deben estar estrictamente regulados para cumplir con las normas GMP.
Salas blancas, enfoque basado en el riesgo y CIP
Por muy difícil que sea, los desarrolladores de ATMPs tienen poderosas herramientas para apoyar el proceso de fabricación de una manera que cumpla con las GMP. La instalación de salas limpias y la aplicación de un enfoque basado en el riesgo mediante el método de análisis de modos de fallo y efectos (AMFE) pueden garantizar la eliminación segura de los tejidos y células procesados en cada etapa de la producción de ATMP. Los controles en proceso (CIP) son también una herramienta esencial para controlar la seguridad y la calidad de todo el proceso de producción.
Para establecer el desarrollo del proceso según el enfoque QbD, QbD ofrece un software para estructurar la optimización del proceso según el paradigma de la calidad por diseño, desde el establecimiento de la CQA y la evaluación exhaustiva de los riesgos hasta el diseño y el análisis de los experimentos en un único paquete. Haga clic aquí para leer más.
Supervisión de la calidad de los medicamentos antirretrovirales: retos pendientes para los desarrolladores de medicamentos antirretrovirales
Lagunas en la legislación
Hoy en día, la regulación de la calidad de los ATMP es un tema candente para las autoridades sanitarias. El uso de productos de origen humano está notoriamente relacionado con la transmisión de enfermedades infecciosas y reacciones adversas.
Por lo tanto, la calidad y la seguridad deben estar garantizadas durante cada etapa de la manipulación de los tejidos y las células procesados. Debido a las características únicas y a la gran heterogeneidad de los ATMP, en lo que respecta a la evaluación de la calidad, es necesario colmar las actuales lagunas normativas.
Por ejemplo en tos análisis de de la materia prima de partida material de partida para la evaluación de la identidad y pureza de una población celular, son difíciles de realizar en un marco estandarizado condiciones.
Evaluación de la potencia o del mecanismo de acción
Lo mismo ocurre con la evaluación de la eficacia o el mecanismo de acción. Una de las razones que subyacen a la discrepancia entre los requisitos de las GMP y la naturaleza de los ATMP es el gran volumen de producto celular que se requiere para las pruebas de calidad, frente a la escasez de material o el tamaño limitado de los lotes, especialmente en el caso de las terapias autólogas y personalizadas.
Las pruebas de evaluación de la calidad también deben cumplir con las normas GMP, lo que significa minimizar la variabilidad relacionada con el operador en favor de procesos estandarizados y reproducibles, haciendo hincapié en la necesidad de automatizar el proceso de fabricación y su sistema de supervisión. Los análisis de inmunofluorescencia basados en el uso de marcadores específicos representan una sólida alternativa a la microscopía para la evaluación de la identidad celular, por ejemplo.
La importancia de una persona cualificada registrada
Está claro que para convertir con éxito la producción de ATMP en un proceso conforme a las directrices de las GMP, hay que hacer ajustes a varios niveles. Para apoyar el control de calidad y satisfacer las necesidades de los desarrolladores de ATMP en lo que respecta a la aplicación de los requisitos de las GMP, una persona cualificada registrada (QP ) puede certificar la calidad y la seguridad del producto final antes de su lanzamiento.
Descargue nuestro Libro Blanco de CbD
- Goula et al. doi:10.14740/jocmr3964
- R. Dream BioPharm International-11-01-2018 Volumen 31, Número 11 Páginas: 30-34
- R. Maciulaitis et al. doi:10.1038/mt.2012.13
- Reglamento CE nº 1394/2007 EUR-Lex – 32007R1394 – ES – EUR-Lex (europa.eu)
- Reglamento CE nº 726/2004 EUR-Lex – 32004R0726 – ES – EUR-Lex (europa.eu)
- F. H. Fritsch et al. doi: 10.1159/000447645
- Directiva comunitaria 2001/83/CE CL2001L0083EN0110010.0001.3bi_cp 1..1 (europa.eu)

